 , Verónica A. Del Vecchio2
, Verónica A. Del Vecchio2  y Sebastián A. Ausili3 *
y Sebastián A. Ausili3 * 
Artículos de Investigación
Abordaje clínico de la estimulación facial en implantes cocleares
Gabriel S. Rosanigo1  , Verónica A. Del Vecchio2
, Verónica A. Del Vecchio2  y Sebastián A. Ausili3 *
y Sebastián A. Ausili3 * 
1Universidad Nacional de Tres de Febrero, Buenos Aires, Argentina / 2Asociación Argentina de Audiología, Buenos Aires, Argentina / 3University of Miami, Dep. Otolaryngology, Miami, Florida, USA.
 OPEN ACCESS
OPEN ACCESS
PEER REVIEWED
REVISIONES
Resumen
El implante coclear es actualmente uno de los dispositivos de rehabilitación neurosensorial más eficaces: brinda la posibilidad de escuchar en personas con hipoacusias severas a profundas que obtienen acceso limitado a los sonidos con la amplificación acústica. Sin embargo, existen complicaciones luego de su implantación, entre las cuales se encuentra la estimulación indeseada del nervio facial. Entre los principales detrimentos que produce la estimulación del nervio facial se encuentran los movimientos involuntarios de cara o cuello y molestia o dolor al usar el implante; en algunos casos se producen solo en algunos canales, pero también puede presentarse en la mayoría o incluso en todos.
El actual abordaje clínico de este problema recurre principalmente a diferentes cambios en la programación del dispositivo. Los recursos para reducirlo abarcan desde cambios en el tipo y modo de la estimulación eléctrica hasta considerar la reimplantación en casos complejos. El presente artículo describe el problema de la estimulación facial y sus posibles causas, además de detallar también las soluciones clínicas que existen en la actualidad. Por último, se discuten nuevos abordajes y posibles líneas de investigación.
Palabras clave
Nervio facial, implante coclear, estimulación eléctrica, pulsos eléctricos, modos de estimulación.
Implicaciones clínicas
La intervención terapéutica de las hipoacusias severas a profundas mediante el implante coclear (IC) ha logrado excelentes resultados auditivos. Sin embargo, y dada la cercanía anatómica al nervio auditivo, los campos eléctricos generados pueden estimular el nervio facial. Este efecto indeseado debe ser abordado por el profesional utilizando las herramientas clínicas disponibles en la actualidad. Este artículo presenta una revisión de la literatura para:
- Indagar sobre la incidencia real de la estimulación del nervio facial (ENF) en los usuarios de IC
- Describir los abordajes clínicos disponibles para el manejo de esta estimulación indeseada
- Discutir las líneas de investigación actuales más relevantes
Esta investigación pretende guiar y actualizar a los profesionales de IC en el manejo de la estimulación del nervio facial en su práctica clínica.
Recibido: 16.09.2022 Revisado: 15.10.2022 Aceptado: 2.11.2022 Publicado: 15.11.2022
Editado por:
Miriam Marrufo-Pérez
Universidad de Salamanca, España.
Revisado por:
Clemencia Baron de Otero
Instituto Nacional de Otología García Gómez, Colombia.
Jose Manuel Gorospe
Gerencia Regional de Salud de Castilla y León, Universidad de Salamanca, España.
Isabel Olleta
Centro de Audiología y Logopedia Isabel Olleta, España.
Introducción
Han pasado menos de 50 años desde que se reportaron las primeras experiencias de estimulación eléctrica del nervio auditivo con un dispositivo implantable (Bergstrom, 1975). Al iniciar la década de 1980 ya eran evidentes los beneficios obtenidos en adultos con implantes (House & Berliner, 1982), por eso este tipo de estimulación se comenzaba a utilizar también en niños (Eisenberg & House, 1982). En la actualidad, la mayoría de los adultos poslinguales logran porcentajes del 70% en percepción del habla en formato abierto en silencio (Lenarz, 2018) y el 80% logra hacer uso del teléfono (Lenarz et al., 2022). A principios de la década de 1990 ya se evidenció la ventaja del uso del IC con respecto a los audífonos al evaluar las habilidades de percepción del habla logradas por niños con hipoacusia profunda (Geers & Moog, 1991). Hoy sabemos que, cuando la implantación es temprana (antes de los 12 meses), los niños pueden alcanzar niveles de desarrollo del lenguaje similares a los de audición normal (Ching et al., 2014) y que los mejores resultados se logran al proporcionar acceso al sonido bilateral (Sharma et al., 2020). Gracias a estos resultados, hay más de un millón de usuarios de esta tecnología en todo el mundo (Fan-Gang, 2022).
Si bien la implantación coclear conlleva riesgos mínimos (House & Berliner, 1982), aún existen problemas que pueden disminuir el beneficio e incluso llegar a hacer imposible su empleo. Uno de estos efectos indeseados es la estimulación no auditiva, en particular, la estimulación del nervio facial (ENF); este problema se ha reportado desde los inicios del IC multicanal (Cohen et al., 1988) y afecta por igual a hombres y mujeres (Smullen et al., 2005), así como a niños y a adultos (Alzhrani, 2020).
La ENF se produce cuando el campo eléctrico generado por alguno de los electrodos se propaga e intercepta alguna porción del nervio facial (Kim et al., 2018, ver Figura 1). Esta estimulación indeseada puede provocar molestias y movimientos ipsilaterales involuntarios de la cara, alrededor del ojo, la boca, el surco nasolabial y la frente (Kelsall et al., 1997). Aunque generalmente la ENF aparece al momento de la activación inicial del IC, también puede darse luego de años de uso (Berrettini et al., 2011). Suele suceder que, tras su aparición, el efecto se agudice con el tiempo afectando a más canales de estimulación y disminuyendo el nivel de carga requerido para provocarlo. Un análisis retrospectivo observó que la ENF puede progresar hasta que el desempeño en la percepción del habla en silencio caiga por debajo de los niveles aceptables debido a la necesidad de desactivar múltiples canales, incluso después de la reimplantación (Polak et al., 2006).
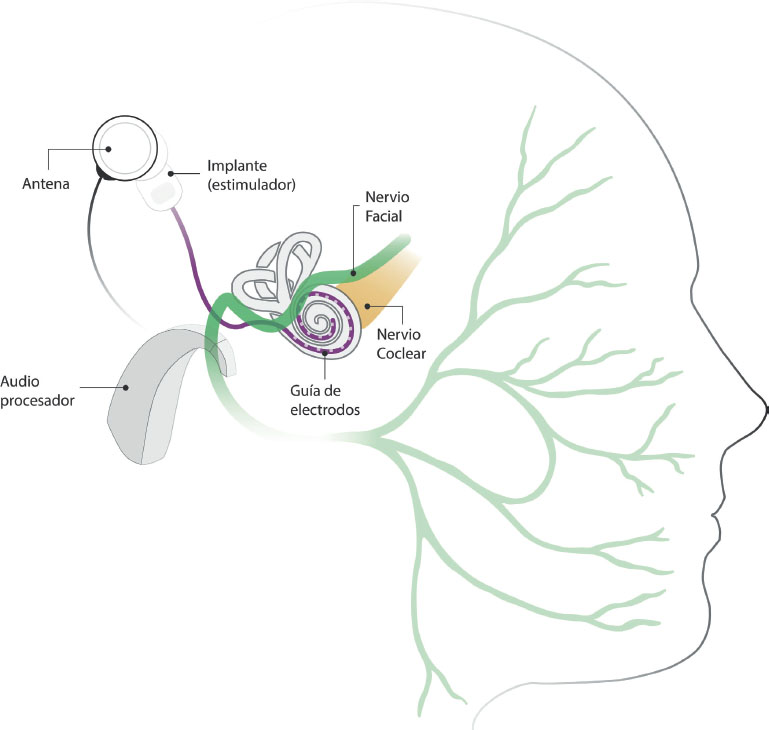
Figure 1. Ilustración de un implante coclear y su cercanía anatómica al nervio facial. El procesador de audio transmite al dispositivo implantado a través de su antena. La guía de electrodos, ubicada en la cóclea, estimula el nervio coclear mediante campos eléctricos generados en sus electrodos activos. La cercanía anatómica entre la estimulación eléctrica y el nervio facial puede provocar una estimulación indeseada del nervio.
Incidencia, relaciones anatómicas y etiológicas
Un estudio reciente analizó treinta y siete publicaciones (que representaban a 5936 usuarios de IC) y observó que el alcance total documentado de la ENF es de aproximadamente un 6% (Van Horn et al., 2020). Esta cifra aumenta significativamente en casos de otoesclerosis, malformaciones u osificaciones cocleares, pudiendo llegar a casi un 50% en estos grupos (Weber et al, 1998). La otoesclerosis provoca una disminución de la impedancia y un aumento de la conducción de la corriente eléctrica a través del hueso, lo que permitiría que esta alcance al nervio facial y produzca la estimulación indeseada (Seyyedi et al., 2013). Recientemente un estudio con 351 oídos con esta etiología reportó una incidencia del 10,5% (Assiri et al., 2022). Otros autores también observaron que la otoesclerosis potencia la probabilidad clínica de ENF en relación con otras patologías cocleares (28,4% frente a 3,5%, respectivamente; Van Horn et al., 2020).
En casos de malformaciones, es probable que la ENF ocurra en la mayoría de los electrodos (Kim et al., 2018). A su vez, las malformaciones del propio nervio facial también aumentan las posibilidades de recibir estímulos del IC (Chen et al., 2021). Asimismo, su incidencia puede ser elevada en casos de fracturas del hueso temporal (Espahbodi et al., 2015).
La proximidad entre la porción laberíntica del nervio facial y la primera vuelta de la cóclea puede ser otro de los factores que facilite la aparición de ENF (Erixon et al., 2009; Kasetty et al., 2019; Aljazeeri et al., 2021). Esto coincide con publicaciones en las que se ha encontrado que los electrodos más cercanos a esta porción son mayormente los que provocan el estímulo indeseado (Smullen et al., 2005; Kelsall et al., 1997). Se ha intentado encontrar características anatómicas que permitan predecir la probabilidad de aparición de la ENF mediante el estudio objetivo de tomografías computerizadas (Hatch et al., 2017). Este grupo encontró diferencias anatómicas significativas en la separación de la cóclea y la porción laberíntica del nervio facial. También se cree que la pared ósea que hay entre la rampa timpánica de la cóclea y el nervio facial puede ser erosionada bajo la presión ejercida por el electrodo (Smullen et al., 2005). Aunque los datos se muestran alentadores, aún son precisos más estudios en esta línea para optimizar y aumentar su poder predictivo.
Un estudio realizado en animales reportó niveles de impedancia reducidos en los electrodos basales, lo que podría permitir una mayor dispersión de la corriente (Niparko et al., 1991). También se ha propuesto una relación de la ENF con las dimensiones del canal óseo del nervio coclear y del conducto auditivo interno, siendo estos más estrechos en los casos donde se presenta (Rah et al., 2016). A su vez, se encontró una correlación entre un acueducto vestibular reducido y un conducto auditivo interno más pequeño en pacientes con ENF (Kamogashira et al., 2017).
Relación de la ENF con el diseño del dispositivo
La revisión sistemática de Van Horn et al. (2020) encontró que los electrodos de pared lateral aumentan significativamente la incidencia de ENF (15,7%) en comparación con los electrodos perimodiolares (4,4%). Esto coincide con lo reportado por otros autores (Burck et al., 2022; Ahn et al., 2009; Matterson et al., 2007; Battmer et al., 2006; Marshall et al., 2005). Sin embargo, existen estudios donde la incidencia entre los distintos formatos de electrodos no difiere (Abdelhamed, 2019). Algunos autores destacan que los electrodos de pared lateral suelen utilizarse más en malformaciones, por lo que al comparar cócleas anatómicamente normales, el diseño de electrodos dejaría de ser un factor significativo (Ahn et al., 2009).
Una mayor proximidad de los electrodos al modiolo, junto con su correcta orientación, puede disminuir la posibilidad de la ENF (Battmer et al., 2006). La proximidad del electrodo al eje central de la cóclea tiende a reducir los niveles de corriente perceptuales necesarios, lo cual ayuda a mantener la estimulación eléctrica por debajo del umbral de la ENF (Seyyedi et al., 2013). Los modelos de dispersión de campo eléctrico sugieren que los electrodos en forma de anillo son los que mayor probabilidad tienen de causar ENF, seguidos de los electrodos de media banda y, por último, los de electrodos de placa (Frijns et al., 2009).
Soluciones clínicas para el manejo de la ENF
Cuando el umbral de la ENF se encuentra por debajo del nivel de confort del paciente, afecta negativamente a su desempeño: es en estos casos que se recurre a cambiar la programación del IC. Una de las soluciones consiste en disminuir el nivel de corriente de los canales o incluso desactivarlos, lo cual perjudica el desempeño del usuario. Cuando se instauran estas acciones, algunos pacientes pueden dejar de utilizar el dispositivo por ausencia de beneficio (Nassiri et al., 2018). Aun así, estas opciones han resultado efectivas en muchos casos (Smullen et al., 2005; Pires et al., 2018).
Las alternativas antes mencionadas constituyen una opción cuando la ENF se presenta en pocos canales, pero no sería la mejor opción en los casos en los que la mayoría de los canales del paciente están afectados. Dependiendo de la severidad de la ENF en estos casos, y dados los escasos recursos clínicos para su manejo, puede considerarse la reimplantación para resolver el problema de la ENF (Battmer et al., 2006; Walia et al., 2021). Aun así, el reemplazo del dispositivo no siempre es una solución, dado que en algunos persiste incluso después de más de una reimplantación (Morris et al., 2004). A veces, aunque el cambio del dispositivo no sea siempre efectivo per se, puede permitir el acceso a nuevas tecnologías para manipular las características de los pulsos o modos de estimulación, lo cual enriquece las herramientas clínicas disponibles para tratar el problema (Polak et al., 2006).
Morfología del pulso
Una alternativa actual para evitar la ENF es modificar la morfología de los pulsos (Fig. 2). Aumentar la duración del pulso o utilizar pulsos trifásicos (en lugar de los bifásicos) son recursos que permiten aumentar la percepción sonora sin ENF.
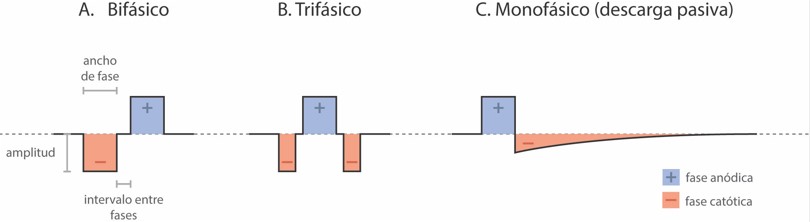
Figure 2. Formatos actuales de pulsos de estimulación de implante coclear. (A) Pulso bifásico; (B) Pulso trifásico; (C) Pulso monofásico de descarga pasiva. En función del que se utilice, las características que pueden modificarse son la amplitud, el ancho de fase y el intervalo entre las mismas.
Incrementar el ancho total de pulso puede entregar una mayor cantidad de carga o energía total con una menor amplitud del pulso (Bahmer et al., 2017), estrategia que ha demostrado resultar eficaz en el manejo de la ENF en reiteradas ocasiones (Polak et al., 2006; Pires et al., 2018; Sefien & Hamada, 2019).
Los pulsos bifásicos generados por los IC suelen constar de dos polaridades opuestas de igual duración y amplitud: una fase negativa o catódica y otra positiva o anódica (Fig. 2A). Los pulsos trifásicos, en cambio, tienen dos fases de igual polaridad con la misma duración y amplitud (catódicas) y, en medio de estas, una fase con polaridad opuesta (anódica) con la misma amplitud y el doble de duración (Fig. 2B). De esta forma, el pulso presenta una carga equilibrada (Braun et al., 2019). Este tipo de pulsos puede beneficiar a usuarios de IC con o sin problemas de ENF (Bonnet et al., 2004). Schatzer et al. (2014) estudiaron utilizar el formato trifásico para estimular de forma selectiva el nervio auditivo en casos de ENF. Desde entonces, se ha comprobado la capacidad de este tipo de pulsos para ayudar a resolver el problema (Schatzer et al., 2014; Bahmer & Baumann, 2016; Bahmer et al., 2017; Braun et al., 2019; Alhabib et al., 2021). Si bien para lograr una sensación de sonoridad igual a la que generan los pulsos bifásicos se necesita un mayor nivel de carga con pulsos trifásicos (Bahmer et al., 2016), los niveles máximos alcanzados sin generar ENF logran ser significativamente más altos (Bahmer & Baumann, 2016; Bahmer et al., 2017, Braun et al. 2019; Alhabib et al., 2021). Esto mejora el rendimiento auditivo en casos con ENF, aumentando la inteligibilidad de palabras (Bahmer & Baumann, 2016; Alhabib et al., 2021).
Aunque menos utilizado, otro recurso para la ENF es aumentar el intervalo entre las fases del pulso, que es el tiempo que transcurre entre las fases positiva y negativa de cada pulso (Fig. 2A). Si bien cada fabricante de IC define su propio valor, algunos permiten modificarlo desde la programación. Este incremento del intervalo permite disminuir los niveles máximos confortables y los umbrales, reduciendo las posibilidades de ENF (Pieper et al., 2020). Además de los pulsos bifásicos y trifásicos, existe un formato llamado monofásico de descarga pasiva (Fig. 2C) que presenta una fase anódica y otra catódica que se descarga de manera pasiva por un efecto capacitivo (Fig. 2C); este formato produce menos dispersión del campo eléctrico que los pulsos bifásicos utilizados normalmente (Zellhuber et al., 2022). También requieren menos carga que los pulsos trifásicos para llegar a niveles confortables (Macherey et al., 2006; Macherey et al., 2008; Carlyon et al., 2013).
Modos de estimulación
La mayoría de los implantes cocleares utilizan un modo de estimulación llamado monopolar (Fig. 3) en el que los electrodos intracocleares activos crean un campo eléctrico en conjunción con un electrodo extracoclear de referencia (Fig. 3A). Este electrodo de referencia puede estar en el encapsulado del implante o en su exterior con una conexión propia y alojado debajo del músculo temporal. Dado que la dispersión del campo eléctrico necesaria entre los electrodos intra- y extracocleares es amplia, aumenta la posibilidad de que el flujo de corriente intercepte el nervio facial.
Con el propósito de disminuir esta dispersión y obtener una estimulación más selectiva, se creó el modo bipolar (BP; Fig. 3B). Este formato utiliza uno de los electrodos intracocleares como referencia de estimulación. Se puede configurar la distancia entre el electrodo activo y el de referencia, siendo BP+1 cuando se utiliza un electrodo adyacente o BP+n dejando n electrodos entremedias. Nótese que esta configuración se encuentra limitada por la cantidad total de electrodos. Limitando la dispersión del campo eléctrico de esta manera es posible reducir significativamente la ENF. Los modelos computacionales han demostrado que con este modo de estimulación se puede predecir un aumento en los umbrales de la ENF (van der Westhuizen et al., 2022).
Existe también un tipo de estimulación particular que resulta eficaz para la ENF conocido como referencia multimodal, llamado Multi-Mode Grounding o Mixed Mode Grounding en inglés (Fig. 3C). En este modo se utilizan como referencia todos los electrodos intracocleares menos el canal que se estimulará, un diseño que puede descargar un 80% de la corriente dentro de la cóclea (Dang, 2017), disminuyendo su dispersión.
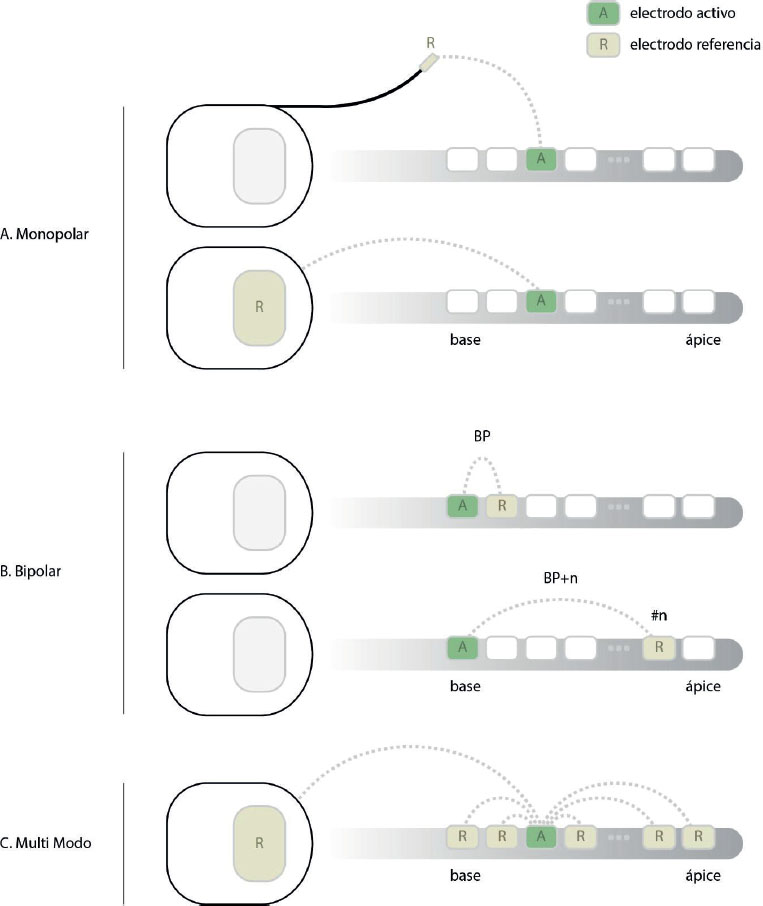
Figure 3. Modos de estimulación de implante coclear actuales. (A) Estimulación monopolar con referencia integrada en el estimulador o externa; (B) estimulación bipolar; (C) Referencia multimodal o Multi-mode Grounding.
En la actualidad, el mismo sistema que utiliza la referencia multimodal también manipula el ancho de fase del pulso (duración del estímulo) con el fin de aumentar la carga entregada al usuario. Nótese a su vez que este sistema utiliza los pulsos monofásicos con descarga pasiva (Fig. 2C). La combinación de estas variables resulta eficaz contra la ENF (Zellhuber et al., 2022 y Eitutis et al., 2022). Aunque pareciera ser una combinación clínicamente muy eficaz, se necesitan más estudios para cuantificar el aporte de cada una de estas características y su efecto real en la disminución de la ENF.
Discusión
Los implantes cocleares han demostrado ser un dispositivo eficaz que mejora la calidad de vida de millones de pacientes. Sin embargo, aún existen algunos problemas que disminuyen el desempeño auditivo de sus usuarios, entre los cuales se encuentra la estimulación indeseada del nervio facial.
La incidencia de este problema no está totalmente consensuada y depende de múltiples factores que se interrelacionan. Aun así, encontrar una solución o un paliativo para este fenómeno es de vital importancia, dado que puede llevar a un usuario a no recibir el beneficio esperado y hasta a abandonar su uso.
Si bien existen diferentes maneras de afrontar este problema, no existe un abordaje único o totalmente eficaz en el manejo de la ENF. Entre las soluciones actuales y al alcance del profesional clínico se encuentra el cambio de algunos parámetros en la programación. Varias investigaciones han mostrado la eficacia en la reducción de la ENF cuando se trabaja con el formato y las características del pulso de estimulación.
Incrementar el ancho de los pulsos o aumentar el intervalo entre ellos ha mejorado la situación de usuarios que sufren de ENF. La estimulación mediante pulsos trifásicos o monofásicos con descarga pasiva son las alternativas más eficaces y novedosas.
Otro abordaje posible pasa por limitar la dispersión del campo eléctrico a través de los diferentes modos de estimulación (es decir, monopolar, bipolar, multimodal). Aunque los datos arrojan beneficios en la ENF al trabajar con ellos, su aplicación actual no se encuentra totalmente optimizada. En la programación actual, un cambio de modo puede conllevar una modificación en la estrategia de codificación del IC, lo que afecta sustancialmente la percepción auditiva del usuario. Por ejemplo, la estimulación bipolar reduce el número final de electrodos activos y esto podría alterar el desempeño auditivo del paciente. A su vez, como se necesita una carga eléctrica mayor en este modo, se incrementa el consumo de las baterías. Deben contemplarse todos estos aspectos al solucionar la ENF.
No todas las opciones mencionadas en este trabajo están disponibles con todos los fabricantes o modelos de IC, será tarea del profesional evaluar en cada caso cuál de las opciones es la indicada para cada dispositivo y paciente. Muchas veces, la combinación de abordajes resulta ser una estrategia adecuada para la reducción o eliminación total de la ENF.
Nuevas investigaciones y formas de estimular el nervio auditivo pueden aportar soluciones para reducir la ENF. Landsberger et al. (2022) han demostrado la posibilidad de percibir bajas frecuencias con electrodos cortos ubicando el electrodo extracoclear de referencia en el ápice de la cóclea; esta nueva configuración redirecciona el campo eléctrico. Aunque este estudio no aborda la problemática del ENF, esta reorientación podría reducir el flujo de corriente sobre el nervio facial. Badenhorst et al. (2021) han hecho diagnósticos mediante modelados tridimensionales computarizados para estudiar la relación entre los campos eléctricos y el nervio facial. Esta nueva propuesta puede otorgar más información sobre el problema y adaptarse a cada paciente de forma particular. Además, han demostrado que se pueden usar estos modelos computacionales para determinar la conductividad del hueso que recubre la cóclea y predecir cuáles son los canales más propensos a la ENF. Estos resultados son alentadores para utilizarse como instrumento clínico en la evolución y programación del IC en presencia de la ENF.
El profesional clínico a cargo debe considerar siempre que los distintos recursos a su disposición para el manejo de esta estimulación indeseada repercuten en el rendimiento auditivo y la calidad de vida del paciente. Muchos de estos cambios pueden ser rechazados por el usuario, dado que implican adaptarse a una nueva forma de escucha. En esta circunstancia es trascendental el asesoramiento, brindando información clara que explique la razón de los cambios. El punto de partida en estos casos consiste en buscar el mejor resultado posible combinando herramientas técnico-clínicas existentes y ofreciendo un acompañamiento integral al paciente.
Conclusiones
La estimulación eléctrica del IC puede generar ENF, que puede variar en función de la etiología y del estado anatómico del oído interno, así como de las características del implante. Actualmente existen recursos en la práctica clínica para su manejo (disminución del nivel de carga, desactivación de canales, cambios en la morfología de los pulsos o en los modos de estimulación). A pesar de que existen nuevas herramientas para su tratamiento, no siempre se puede eliminar esta estimulación indeseada. Son necesarios nuevos estudios para cuantificar la efectividad de estas herramientas, así como crear tecnologías nuevas para erradicar este problema.
Bibliografía
Abdelhamed, M. Z. (2019). Evaluation of the Triphasic Pulse Stimulation in Eliminating Facial Nerve Stimulation in Cochlear Implant Recipients. Glob J Oto, 19(2); https://doi.org/10.19080/GJO.2019.19.556007.
Ahn JH, Oh SH, Chung JW, Lee KS. (2009). Facial nerve stimulation after cochlear implantation according to types of Nucleus 24-channel electrode arrays. Acta Otolaryngol, 129(6):588–91. https://doi.org/10.1080/00016480802325965.
Alhabib S, Abdelsamad Y, Yousef M & Alzhrani F. (2021). Performance of cochlear implant recipients fitted with triphasic pulse patterns. Eur Arch Otorhinolaryngol, 278(9):3211–3216. https://doi.org/10.1007/s00405-020-06382-0.
Aljazeeri IA, Khurayzi T, Al-Amro M, Alzhrani F, Alsanosi A. (2021). Evaluation of computed tomography parameters in patients with facial nerve stimulation post-cochlear implantation. Eur Arch Otorhinolaryngol, 278(10):3789–3794. https://doi.org/10.1007/s00405-020-06486-7.
Alzhrani F, Halawani R, Basodan S, Hudeib R. (2020). Investigating facial nerve stimulation after cochlear implantation in adult and pediatric recipients. Laryngoscope, 131(2):374–379. https://doi.org/10.1002/lary.28632.
Assiri M, Khurayzi T, Alshalan A, Alsanosi A. (2022). Cochlear implantation among patients with otosclerosis: a systematic review of clinical characteristics and outcomes. Cochlear implantation among patients with otosclerosis: a systematic review of clinical characteristics and outcomes, 279(7):3327–3339. https://doi.org/10.1007/s00405-021-07036-5.
Badenhorst W, Hanekom T, Gross L, Hanekom JJ. (2021). Facial nerve stimulation in a post-meningitic cochlear implant user: using computational modelling as a tool to probe mechanisms and progression of complications on a case-by-case basis. Cochlear Implants Int, 22(2):68–79. https://doi.org/10.1080/14670100.2020.1824431.
Bahmer A, Adel Y, Baumann U. (2017). Preventing Facial Nerve Stimulation by Triphasic Pulse Stimulation in Cochlear Implant Users: Intraoperative Recordings. Otol Neurotol, 38(10):e438–e444. https://doi.org/10.1097/MAO.0000000000001603.
Bahmer A, Baumann U. (2016). The underlying mechanism of preventing facial nerve stimulation by triphasic pulse stimulation in cochlear implant users assessed with objective measure. Otol Neurotol, 37(9):1231–7. https://doi.org/10.1097/MAO.0000000000001156.
Battmer R, Pesch J, Stöver T, Lesinski-Schiedat A, Lenarz M, Lenarz T. (2006). Elimination of facial nerve stimulation by reimplantation in cochlear implant subjects. Otol Neurotol, 27(7):918–22. https://doi.org/10.1097/01.mao.0000235374.85739.c6.
Bergstrom, L. (1975). Some pathologies of sensory and neural hearing loss. Can J Otolaryngol Suppl, 2:1–28.
Berrettini S, Vito de A, Bruschini L, Passetti S, Forli F. (2011). Facial nerve stimulation after cochlear implantation: our experience. Acta Otorhinolaryngol Ital, 31:11–6.
Bonnet RM, Frijns JH, Peeters S, Briaire JJ. (2004). Speech recognition with a cochlear implant using triphasic charge-balanced pulses. Acta Otolaryngol, 124(4):371–5. https://doi.org/10.1080/00016480410031084.
Braun K, Walker K, Surth W, Lowenheim H & Tropitzsch A. (2019). Triphasic Pulses in Cochlear Implant Patients With Facial Nerve Stimulation. Starnberg : Otol Neurotol, 40(10):1268–1277. https://doi.org/10.1097/MAO.0000000000002398.
Burck I, Helal RA, Naguib NNN, Nour-Eldin NA, Scholtz JE, Martin S, Leinung M, Helbig S, Stöver T, Lehn A, Vogl TJ. (2022). Postoperative radiological assessment of the mastoid facial canal in cochlear implant patients in correlation with facial nerve stimulation. Eur Radiol, 32(1):234–242. https://doi.org/10.1007/s00330-021-08128-w.
Carlyon RP, Deeks JM, Macherey O. (2013). Polarity effects on place pitch and loudness for three cochlear-implant designs and at different cochlear sites. J Acoust Soc Am, 134(1):503–9. https://doi.org/10.1121/1.4807900.
Chen J, Chen B, Zhang L, Li Y. (2021). Severe and persistent facial nerve stimulation after cochlear implantation in a patient with cochlear-facial dehiscence: a case report. J Int Med Res, 49(11):3000605211057823. https://doi.org/10.1177/03000605211057823.
Ching TY, Day J, Van Buynder P, Hou S, Zhang V, Seeto M, Burns L, Flynn C. (2014). Language and speech perception of young children with bimodal fitting or bilateral cochlear implants. Cochlear Implants Int, 15 Suppl 1(0 1):S43–6. https://doi.org/10.1179/1467010014Z.000000000168.
Cohen NL, Hoffman RA, Stroschein M. (1988). Medical or surgical complications related to the nucleus multichannel cochlear implant. Ann Otol Rhinol Laryngol, 97:8–13; https://doi.org/10.1177/00034894880975s202.
Dang, K. (2017). Electrical conduction models for cochlear implant stimulation. HAL Open Science.
Eisenberg LS, House WF. (1982). Initial experience with the cochlear implant in children. Ann Otol Rhinol Laryngol Suppl, (2 Pt 3):67–73.
Eitutis ST, Carlyon RP, Tam YC, Salorio-Corbetto M, Vanat Z, Tebbutt K, Bardsley R, Powell HRF, Chowdhury S, Tysome JR, Bance ML. (2022). Management of Severe Facial Nerve Cross Stimulation by Cochlear Implant Replacement to Change Pulse Shape and Grounding Configuration: A Case-series. Otol Neurotol, 43(4):452–459. https://doi.org/10.1097/MAO.0000000000003493.
Erixon E, Högstorp H, Wadin K, Rask-Andersen H. (2009). Variational anatomy of the human cochlea: implications for cochlear implantation. Otol Neurotol, 0(1):14–22. https://doi.org/10.1097/MAO.0b013e31818a08e8.
Espahbodi M, Sweeney AD, Lennon KJ, Wanna GB. (2015). Facial nerve stimulation associated with cochlear implant use following temporal bone fractures. Am J Otolaryngol, 36(4):578–582; https://doi.org/10.1016/j.amjoto.2015.04.003.
Fan-Gang, Z. (2022). Celebrating the one millionth cochlear implant. JASA Express, Lett. 2 077201; https://doi.org/10.1121/10.0012825.
Frijns JH, Kalkman RK, Briaire JJ. (2009). Stimulation of the facial nerve by intracochlear electrodes in otosclerosis: a computer modeling study. Otol Neurotol, 30(8):1168–74. https://doi.org/10.1097/MAO.0b013e3181b12115.
Geers AE, Moog JS. (1991). Evaluating the benefits of cochlear implants in an education setting. Am J Otol, 12 Suppl:116–25.
Hatch JL, Rizk HG, Moore MW, Camposeo EE, Nguyen SA, Lambert PR, Meyer TA, McRackan TR. (2017). Can Preoperative CT Scans Be Used to Predict Facial Nerve Stimulation Following CI? Otol Neurotol, 38(8):1112–1117. https://doi.org/10.1097/MAO.0000000000001497.
House WF, Berliner KI. (1982). The cochlear implant. Otolaryngol Clin North Am, 15(4):917–23.
Kamogashira T, Iwasaki S, Kashio A, Kakigi A, Karino S, Matsumoto Y, Yamasoba T. (2017). Prediction of Intraoperative CSF Gusher and Postoperative Facial Nerve Stimulation in Patients With Cochleovestibular Malformations Undergoing Cochlear Implantation Surgery. Otol Neurotol, 38(6):e114–e119. https://doi.org/10.1097/MAO.0000000000001440.
Kasetty VM, Zimmerman Z, King S, Seyyedi M. (2019). Comparison of Temporal Bone Parameters before Cochlear Implantation in Patients with and without Facial Nerve Stimulation. J Audiol Otol, 23(4):193–196. https://doi.org/10.7874/jao.2019.00129.
Kelsall DC, Shallop JK, Brammeier TG, Prenger EC. (1997). Facial nerve stimulation after Nucleus 22-channel cochlear implantation. Am J Otol, 18(3):336–341.
Kim YR, Yoo MH, Lee JY, Yang CJ, Park JW, Kang BC, Kang WS, Ahn JH, Chung JW, Park HJ. (2018). Characteristics and pathogenesis of facial nerve stimulation after cochlear implant surgeries: A single-centre retrospective analysis from 1151 patients. Clin Otolaryngol, 43(5):1396–1400. https://doi.org/10.1111/coa.13153.
Landsberger DM, Stupak N, Spitzer ER, Entwisle L, Mahoney L, Waltzman SB, McMenomey S, Friedmann DR, Svirsky MA, Shapiro W, Roland JT Jr. (2022). Stimulating the Cochlear Apex Without Longer Electrodes: Preliminary Results With a New Approach. Otol Neurotol, 43(5):e578–e581. https://doi.org/10.1097/MAO.0000000000003529.
Lenarz T, Büchner A, Illg A. (2022). Cochlear Implantation: Concept, Results Outcomes and Quality of Life. Laryngorhinootologie, 101(S 01):S36-S78. English, German. https://doi.org/10.1055/a-1731-9321.
Lenarz, T. (2018). Cochlear implant - state of the art. GMS Curr Top Otorhinolaryngol Head Neck Surg, 16:Doc04. https://doi.org/10.3205/cto000143.
Macherey O, Carlyon RP, van Wieringen A, Deeks JM, Wouters J. (2008). Higher sensitivity of human auditory nerve fibers to positive electrical currents. J Assoc Res Otolaryngol, 9(2):241–51. https://doi.org/10.1007/s10162-008-0112-4.
Macherey O, van Wieringen A, Carlyon RP, Deeks JM, Wouters J. (2006). Asymmetric pulses in cochlear implants: effects of pulse shape, polarity, and rate. J Assoc Res Otolaryngol, 7(3):253–66. https://doi.org/10.1007/s10162-006-0040-0.
Marshall AH, Fanning N, Symons S, Shipp D, Chen JM, Nedzelski JM. (2005). Cochlear implantation in cochlear otosclerosis. Laryngoscope, 115(10):1728–33. https://doi.org/10.1097/01.mlg.0000171052.34196.ef.
Matterson AG, O'Leary S, Pinder D, Freidman L, Dowell R, Briggs R. (2007). Otosclerosis: selection of ear for cochlear implantation. Otol Neurotol, 28(4):438–46. https://doi.org/10.1097/MAO.0b013e31803115eb.
Morris DP, Maessen H, Creaser C, van Wijhe R, Bance M. (2004). Refractory severe facial nerve cross-stimulation and loss of auditory sensation after ten years of uneventful cochlear implant use. A rare and challenging case. Cochlear Implants Int, 5(3):117–24. https://doi.org/10.1179/cim.2004.5.3.117.
Nassiri, A. M., Yawn, R. J., Dedmon, M. M., O’Connell, B. P., Holder, J. T., Haynes, D. S., & Rivas, A. (2018). Facial nerve stimulation patterns associated with cochlear implantation in labyrinthitis ossificans. Otology and Neurotology, 39(10), e992–e995. https://doi.org/10.1097/MAO.0000000000002028
Niparko JK, Oviatt DL, Coker NJ, Sutton L, Waltzman SB, Cohen NL. (1991). Facial nerve stimu-lation with cochlear implant. Otolaryngol Head Neck Surg. 104:826–830. 104(6):826–30. https://doi.org/10.1177/019459989110400610
Pieper SH, Brill S, Bahmer A. (2020). Loudness Perception and Dynamic Range Depending on Interphase Gaps of Biphasic Pulses in Cochlear Implants. Ear Hear, 41(5):1251–1257. https://doi.org/10.1097/AUD.0000000000000843.
Pires JS, Melo AS, Caiado R, Martins JH, Elói Moura J, Silva LF. (2018). Facial nerve stimulation after cochlear implantation: Our experience in 448 adult patients. Cochlear Implants Int, 19(4):193–197. https://doi.org/10.1080/14670100.2018.1452561.
Polak M, Ulubil SA, Hodges AV, Balkany TJ. (2006). Revision cochlear implantation for facial nerve stimulation in otosclerosis. Arch Otolaryngol Head Neck Surg, 132(4):398–404. https://doi.org/10.1001/archotol.132.4.398.
Rah YC, Yoon YS, Chang MY, Lee JY, Suh MW, Lee JH, Oh SH, Chang SO, Park MK. (2016). Facial nerve stimulation in the narrow bony cochlear nerve canal after cochlear implantation. Laryngoscope, 126(6):1433–9. https://doi.org/10.1002/lary.25655.
Schatzer R. (2014). Selective suppression of facial nerve activation in CI patients with tripha sic stimulation. 13th International Conference on Cochlear Implants and Other Implantable Auditory Implants. Munich
Sefien I, Hamada S. (2019). Facial Nerve Stimulation as a Complication of Cochlear Implantation. Indian J Otolaryngol Head Neck Surg, 71(4):474–479. https://doi.org/10.1007/s12070-019-01649-3.
Seyyedi M, Herrmann BS, Eddington DK, Nadol JB. (2013). The pathologic basis of facial nerve stimulation in otosclerosis and multi-channel cochlear implantation. Otol Neurotol, 34:1603–9; https://doi.org/10.1097/MAO.0b013e3182979398.
Sharma SD, Cushing SL, Papsin BC, Gordon KA. (2020). Hearing and speech benefits of cochlear implantation in children: A review of the literature. Int J Pediatr Otorhinolaryngo, 133:109984. https://doi.org/10.1016/j.ijporl.2020.109984.
Smullen JL, Polak M, Hodges AV, Payne SB, King JE 3rd, Telischi FF, Balkany TJ. (2005). Facial nerve stimulation after cochlear implantation. Laryngoscope, 115(6):977–82. https://doi.org/10.1097/01.
van der Westhuizen J, Hanekom T, Hanekom JJ. (2022). Apical Reference Stimulation: A Possible Solution to Facial Nerve Stimulation. Ear Hear, 43(4):1189–1197. https://doi.org/10.1097/AUD.0000000000001170.
van Horn A, Hayden C, Mahairas AD, Leader P, Bush ML. (2020). Factors Influencing aberrant facial nerve stimulation following cochlear implantation: a systematic review and meta-analysis. Otol Neurotol., 41(8):1050–1059; https://doi.org/10.1097/MAO.0000000000002693.
Walia A, Shew MA, Ortmann AJ, Buchman CA, Herzog JA. (2021). Hearing Preservation After Cochlear Reimplantation Using Electrocochleography: A Case Report. Laryngoscope, 131(10):2348–2351. https://doi.org/10.1002/lary.29734.
Weber BP, Dillo W, Dietrich B, Maneke I, Bertram B, Lenarz T. (1998). Pediatric cochlear implantation in cochlear malformations. Am J Otol, 19(6):747–53.
Zellhuber N, Helbig R, James P, Bloching M, Lyutenski S. (2022). Multi-mode grounding and monophasic passive discharge stimulation avoid aberrant facial nerve stimulation following cochlear implantation. Clin Case Rep., 10(2):e05360. https://doi.org/10.1002/ccr3.5360.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de interés. El trabajo se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como posible conflicto de interés.
Contribuciones de los autores
GR y VD: conceptualización, borrador, revisión, edición del manuscrito y visualización; SA: conceptualización, supervisión y redacción, revisión y edición del manuscrito.
Cómo citar:
Rosanigo, G., Del Vecchio, V., & Ausili, S. (2022).
Abordaje clínico de la estimulación facial en
implantes cocleares. Auditio, 6, e90.
https://doi.org/10.51445/sja.auditio.vol6.2022.0090
Correspondencia
*Sebastián A. Ausili
1120 NW 14th St, Miami, FL 33136, USA
email: s.ausili@miami.edu
Oficina Editorial
Corrección: Emma Goldsmith.
Traducción: Tomás Pérez Pazos.
Producción: Publicaciones Académicas.