Artículos de Investigación
Complicaciones en osteointegración percutánea: ¿justifican realmente una disminución en su uso?
Marta Núñez-Gutiérrez1* , Juan Castro-Jiménez1
, Juan Castro-Jiménez1 , Francisco Fernández-Nogueras Jiménez1, Juan M. Espinosa-Sánchez2, 3, 4, 5
, Francisco Fernández-Nogueras Jiménez1, Juan M. Espinosa-Sánchez2, 3, 4, 5 , Juan García-Valdecasas2, 6
, Juan García-Valdecasas2, 6
1 Departmento de Otorrinolaringología, Hospital Universitario Virgen de las Nieves, Granada, España /2 Departmento de Otorrinolaringología, Instituto de Investigación Biosanitaria ibs.GRANADA, Hospital Universitario Virgen de las Nieves, Granada, España / 3 Grupo de Otología y Neurotología CTS495, Departamento de Medicina Genómica, GENYO, Centro Pfizer-Universidad de Granada-Junta de Andalucía de Genómica e Investigación Oncológica, Granada, España / 4 División of Otolaringología, Departmento de Cirugía, Universidad de Granada, Granada, España / 5 Programa de Patología Neurosensorial, Centro de Investigación Biomédica en Red en Enfermedades Raras (CIBERER), Madrid, España- 6 Clínica SENT, Granada, España.
 OPEN ACCESS
OPEN ACCESS
PEER REVIEWED
INVESTIGACIÓN ORIGINAL
DOI: 10.51445/sja.auditio.vol7.2023.0089
Resumen
Introducción: Los implantes de conducción ósea percutáneos son el modelo clásico de osteointegración y constituyen una alternativa en el tratamiento de la hipoacusia conductiva y mixta. En los últimos años han aumentado sus indicaciones, aunque se cuestiona su uso debido a las complicaciones locales que ocasionan.
Nuestro objetivo es describir las complicaciones producidas por la colocación de dispositivos osteointegrados percutáneos en nuestro centro.
Material y métodos: Se ha realizado un estudio longitudinal retrospectivo que incluyó a 57 pacientes consecutivos a los que se les implantó un dispositivo de conducción por vía ósea percutánea de tipo Baha®. Las indicaciones clínicas principales fueron la otitis media crónica y las malformaciones auriculares. Para describir las complicaciones locales periimplante se empleó la clasificación de Holgers.
Resultados: Tras un seguimiento medio de 12 meses (intervalo: 4-48 meses), un 26,31% de los pacientes presentaron algún tipo de complicación del tejido blando periimplante. Únicamente un paciente (1,75%) presentó reacciones graves que precisaron la extracción del implante. Las complicaciones en la edad pediátrica fueron llamativamente superiores alcanzando el 42,85% de los niños implantados.
Conclusiones: Nuestra tasa de complicaciones se sitúa en el límite inferior del intervalo de complicaciones locales descrito en la bibliografía, que aporta cifras muy heterogéneas de hasta el 70%. La mayoría de ellas son de carácter leve y se resuelven con tratamiento antibiótico tópico. Sin embargo, esta tasa es más elevada en niños.
Palabras clave
Implante de conducción ósea percutáneo, complicaciones locales, Holgers, BAHA, Baha®.
Implicaciones Clínicas
Las reacciones cutáneas periimplante mayores son escasas y no justifican el cambio per se a la osteointegración transcutánea. La elección del dispositivo osteointegrado más adecuado para cada paciente debe realizarse en primer lugar en función de la indicación audiológica prestando atención a la pérdida auditiva en frecuencias agudas, donde el uso de dispositivos transcutáneos pasivos podría determinar una falta de discriminación. La experiencia quirúrgica de cada equipo y los motivos económicos también se deben tener en cuenta.
Recibido: 15.09.2022 Revisado: 05.12.2022 Aceptado: 25.04.2023 Publicado: 02.11.2023
Editado por:
Sebastián Ausili
University of Miami.
Revisado por:
María José Lavilla Martín de Valmaseda
Hospital Clínico Universitario Lozano Blesa, España.
Marta Herrero Romero
Hospital Universitario Quirón, España.
Mario Zernotti
Universidad Católica de Córdoba, Argentina.
Javier Gavilán
Hospital Universitario de la Paz, España.
Introducción
Durante los últimos años ha aumentado el interés y la aceptación de los implantes de conducción ósea (Lavilla et al., 2019). Se consideran una opción de tratamiento eficaz en pacientes con hipoacusia conductiva, mixta o hipoacusia neurosensorial profunda con audición normal contralateral, habiéndose producido una ampliación en las indicaciones tanto actuales como novedosas (Lavilla Martín de Valmaseda et al., 2019; Yuen et al., 2009).
Los implantes de conducción ósea son dispositivos médicos semiimplantables que están formados por un procesador externo, un micrófono y un amplificador. Transmiten el sonido hasta la cápsula ótica permitiendo la vibración de los líquidos intracocleares, evitando el oído externo y el oído medio (Lavilla Martín de Valmaseda et al., 2019). En función de cómo se realiza la conexión entre el procesador externo y el implante se distinguen dos tipos de implantes de conducción ósea: percutáneos y transcutáneos (Figura 1). En los percutáneos existe una conexión directa entre ambos, ya que el implante atraviesa la piel, mientras que en los transcutáneos la comunicación se realiza a través de una piel intacta y se diferencian en sistemas de conducción pasiva o skin-drive (vibración transmitida a través de la piel intacta por imanes) y conducción activa o direct-drive (vibración producida directamente por el implante; Lavilla Martín de Valmaseda et al., 2019).
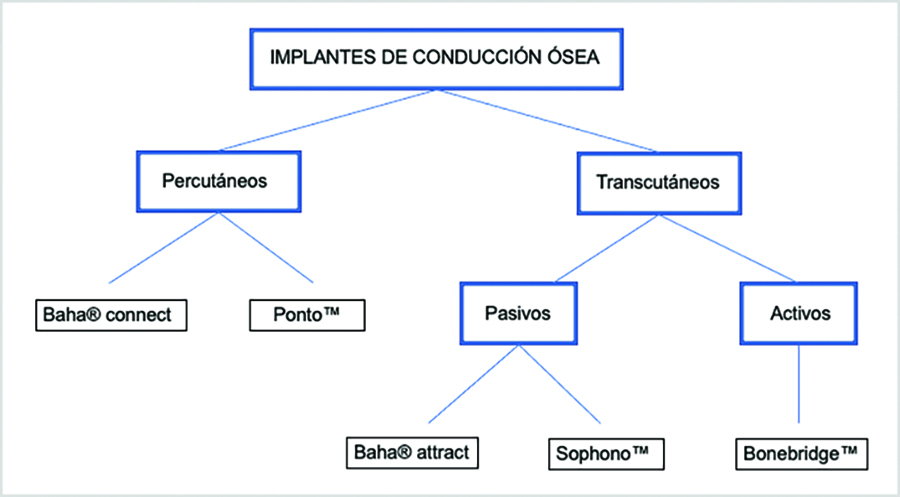
Figura 1. Tipos de implantes de conducción ósea
Los dispositivos transcutáneos pasivos consisten en un implante de titanio que se coloca debajo de la piel con un pedestal que protruye bajo la misma. El sonido se transmite a través de la piel intacta desde un transductor pasivo al pedestal, mientras que los dispositivos transcutáneos activos se caracterizan porque la vibración es generada directamente por el implante después de recibir el sonido correctamente procesado (Reinfeldt et al., 2015).
El fenómeno de osteointegración previamente descrito en la literatura explica el crecimiento de tejido óseo en contacto con el implante de titanio, formando una conexión estructural y funcional entre el hueso y la superficie del implante que permite la transmisión del sonido. (Brånemark et al., 2001; Tjellström et al., 1981). La principal vía de transmisión es la frontal para las frecuencias graves, no estando tan bien definido para las frecuencias agudas (Dufour-Fournier et al., 2022). Posteriormente se han desarrollado implantes de conducción ósea en los que no es necesaria la osteointegración de sus componentes de titanio (Bonebridge™; Zernotti y Sarasti, 2015).
Los implantes de conducción ósea percutáneos representan el modelo clásico de osteointegración, con unos excelentes resultados audiológicos, (especialmente en las frecuencias agudas), aunque son menos estéticos. Podrían ser superiores a los transcutáneos debido a la atenuación producida en este tipo de dispositivos por interposición de la piel de hasta 5-20 dB en el intervalo de frecuencias entre 1 y 4 KHz (Verstraeten et al., 2009). Los dispositivos transcutáneos constituyen una solución más estética, lo que ha hecho aumentar su uso en los últimos años. Algunos autores han señalado una menor frecuencia de complicaciones locales empleando dispositivos transcutáneos, lo que también favorecería su empleo (Ellsperman et al., 2021). Aun así, la fuerza requerida para mantener el imán en su lugar y que se produzca una correcta transmisión del sonido puede producir irritación de la piel y los tejidos percutáneos, lo que lleva en los casos más extremos a la necrosis (Chen et al., 2017). Las complicaciones mayores más frecuentes de los implantes transcutáneos pasivos son el seroma, el hematoma, la infección local o las úlceras cutáneas, que suponen en total un 5,2% de todos los pacientes (Cooper et al., 2017).
La implantación quirúrgica de los dispositivos de conducción ósea ha evolucionado durante las últimas décadas. Actualmente, la mayoría de los procedimientos se realizan en un único tiempo bajo anestesia local o general empleando una gran variedad de incisiones (Calon et al., 2018). En pacientes pediátricos, donde el espesor del cráneo es menor, se debe producir la osteointegración antes de la colocación del procesador y se podría considerar un procedimiento en dos fases (Roman et al., 2011; Verheij et al., 2016). El procedimiento quirúrgico clásico incluye el adelgazamiento de la piel alrededor del implante con el objeto de asegurar un contacto adecuado de la piel con el tejido óseo y disminuir el riesgo de sobrecrecimiento cutáneo e infecciones locales (Cass y Mudd, 2010). Se han desarrollado nuevas técnicas quirúrgicas para tratar de minimizar las complicaciones locales como la técnica de incisión lineal sin reducción del tejido blando (den Besten et al., 2016), la técnica de perforación sin necesidad de incisión y la técnica de cirugía mínimamente invasiva (MIPS; Johansson et al., 2017).
El estado de la piel y el grosor craneal pueden influir en el desarrollo de complicaciones cutáneas después de la cirugía de implantación de dispositivos osteointegrados percutáneos. La piel delgada, frágil o con antecedentes de enfermedades cutáneas como psoriasis o eccema puede aumentar el riesgo de irritación cutánea, aparición de úlceras por presión o infección posquirúrgica (Calon et al., 2018). Otro factor de riesgo en el fallo del dispositivo en pacientes pediátricos es su nivel socioeconómico (Kraai et al., 2011).
Por otro lado, un mayor grosor de la calota se considera más favorable para la implantación, ya que proporciona una mayor estabilidad y reduce el riesgo de migración del implante. La evaluación preoperatoria y una selección adecuada de los pacientes pueden ayudar a reducir el riesgo de complicaciones y lograr resultados más satisfactorios. Algunos autores proponen la realización de TAC de forma rutinaria y la aplicación de protocolos radiológicos específicos previos a la cirugía (Brenner et al., 2007).
El objetivo de este estudio es describir las complicaciones producidas por la colocación de dispositivos osteointegrados percutáneos en nuestro centro.
Métodos
Se realizó un estudio longitudinal retrospectivo que incluyó a 57 pacientes consecutivos a los que se les implantó un dispositivo de conducción por vía ósea percutánea de tipo Baha® Connect (CochlearTM) en un hospital de tercer nivel entre enero de 2015 y diciembre de 2021. El procesador externo fue elegido en función de los umbrales audiométricos por vía ósea, oscilando entre 45, 55, y 65 dB HL para los procesadores Baha® 5, Baha® 5 Power y Baha® 5 SuperPower, respectivamente. Todos los pacientes evaluados contaban con un estudio audiológico completo que incluyó otomicroscopia, audiometría tonal liminar y audiometría verbal. Previa a la intervención, se efectuó en todos los casos una prueba del dispositivo adaptado mediante una banda elástica en la consulta durante un tiempo medio de dos horas.
La técnica quirúrgica empleada fue la incisión arciforme con implante colocado fuera de la incisión. Tras realizar la incisión y disección del tejido celular subcutáneo, se elevó el periostio, después se avellanó el lecho óseo y se colocó el pedestal; la elección del tamaño de este se hizo en función del espesor de la piel y del tejido celular subcutáneo. La externalización del pedestal se llevó a cabo fuera de la incisión con técnica de perforación. A continuación, se suturó y se colocó la placa de cicatrización, que se cubrió con una gasa impregnada con pomada antibiótica de bacitracina, neomicina y polimixina B.
Todas las intervenciones se realizaron bajo anestesia general combinada con infiltración de anestésico local con vasoconstrictor. Las complicaciones se categorizaron siguiendo la clasificación de Holgers, que estratifica las complicaciones cutáneas periimplante (tabla 1; Ellsperman et al., 2021).
Tabla 1. Clasificación de Holgers
Grado |
Reacción cutánea |
Tratamiento |
0 |
Ausencia |
Limpieza de detritos |
1 |
Eritema |
Tratamiento local |
2 |
Eritema + exudado |
Tratamiento local |
3 |
Eritema + exudado + tejido de granulación |
Cirugía de revisión |
4 |
Reacciones graves |
Extracción |
Resultados
La muestra inicial constaba de 63 pacientes, de los cuales se excluyeron seis: tres por pérdida en el seguimiento y tres por presentar un dispositivo Baha® adaptado mediante Softband. La muestra quedó conformada por 57 pacientes con una edad media de 49,80 ± 20,02 años, de los cuales el 56,89% eran mujeres. La edad media del subconjunto de la edad adulta fue de 55,26 ± 15,80 años. Del total, siete pacientes (el 12,28%) eran menores de 15 años, con una edad media de 10,42 ± 3,30 años. El seguimiento medio de los pacientes fue de 12 meses (intervalo: 4-48 meses) e incluyó visitas periódicas en la consulta de otología con una periodicidad semanal durante las primeras dos semanas, mensual hasta los seis meses y semestral posteriormente en la mayoría de los pacientes, si bien existen variaciones en función de la evolución de cada paciente. Se registró la clasificación de Holgers en cada visita en el caso de que el grado se encontrase entre 1-4. La programación del procesador de sonido se llevó a cabo en nuestro centro en la visita correspondiente al primer mes tras la intervención quirúrgica.
Alrededor del 80% de las complicaciones locales periimplante ocurrieron en los primeros dos meses después de la intervención quirúrgica. Sin embargo, hubo tres pacientes adultos sin antecedentes médicos relevantes que experimentaron infecciones recurrentes durante los primeros años después de la cirugía. El periodo de seguimiento promedio es muy variable en los estudios publicados, dado que oscila entre tres y 61 meses en la revisión sistemática publicada por Mohamad et al. (2016)
En la tabla 2 detallamos las indicaciones clínicas de implantación del dispositivo. En las tablas 3 y 4 se especifican las indicaciones clínicas para los subgrupos de población pediátrica y adulta de la muestra. En el caso de los pacientes con otitis media crónica, los pacientes referían episodios de otorrea frecuente que impedían el uso de audioprótesis convencionales o bien limitaban su rendimiento. No contamos con ningún paciente que haya recibido un implante con diagnóstico de hipoacusia neurosensorial profunda unilateral utilizando estimulación cruzada de la señal de tipo CROS (contralateral routing of signals, transmisión contralateral de señales).
Tabla 2. Indicaciones clínicas de colocación de dispositivos de conducción ósea percutáneos en nuestra muestra
Diagnóstico |
n = 57 |
Otitis media crónica simple/colesteatomatosa |
42 |
Malformaciones congénitas del pabellón auricular y conducto auditivo externo |
10 |
Otoesclerosis con mala repuesta a la cirugía |
4 |
Mala adaptación a audioprótesis |
1 |
Tabla 3. Indicaciones clínicas de colocación de dispositivos de conducción ósea percutáneos en la población pediátrica
Diagnóstico |
n = 7 |
Malformaciones congénitas del pabellón auricular y conducto auditivo externo |
6 |
Otitis media crónica colesteatomatosa |
1 |
Tabla 4. Indicaciones clínicas de colocación de dispositivos de conducción ósea percutáneos en la población adulta
Diagnóstico |
n = 50 |
Otitis media crónica simple / colesteatomatosa |
41 |
Malformaciones congénitas del pabellón auricular y conducto auditivo externo |
4 |
Otoesclerosis con mala repuesta a la cirugía |
4 |
Mala adaptación a audioprótesis |
1 |
Del total de pacientes estudiados, 15 (el 26,31%) presentaron algún tipo de complicación local, siendo la mayoría de ellas (el 93,33%) menores (grados 1 y 2 de Holgers; tabla 5). Las complicaciones en la edad pediátrica fueron llamativamente superiores. Del total de 7 niños receptores de implantes, 3 (el 42,85%) presentaron algún tipo de complicación. Dos de estos casos pediátricos se estratificaron como Holgers de grado 1, mientras que en un paciente se produjo un sobrecrecimiento de tejido sobre el implante que precisó el recambio (Holgers 4; figura 2). Un paciente pediátrico presentó extrusión espontánea de implante y otro paciente extrusión tras traumatismo local. La tasa de complicaciones en la edad adulta fue del 24% del total, todas ellas estratificadas como de grado leve (Holgers 1 y 2). No se presentaron complicaciones locales graves (Holgers 3 y 4; figura 3).
Tabla 5. Complicaciones de tejido blando periimplante categorizadas según la clasificación de Holgers en el conjunto de la muestra
Complicaciones cutáneas |
Tratamiento |
Número de pacientes (%) |
Holgers 0 |
No precisa |
42 (73,68%) |
Holgers 1 |
No precisa |
3 (5,26%) |
Holgers 2 |
Antibiótico tópico + controles semanales |
11 (19,29%) |
Holgers 3 |
Cirugía de revisión |
0 (0,00%) |
Holgers 4 |
Extracción del implante |
1 (1,75%) |
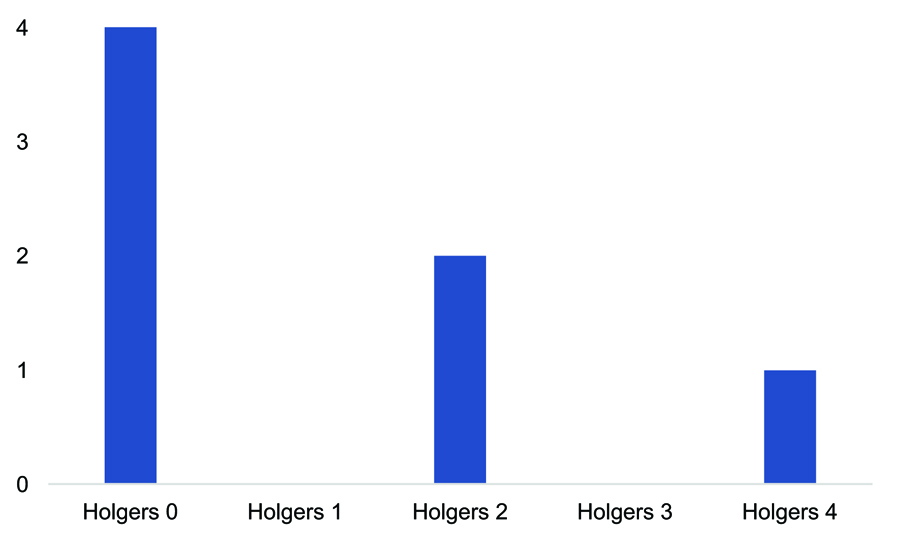
Figura 2. Complicaciones cutáneas en la edad pediátrica
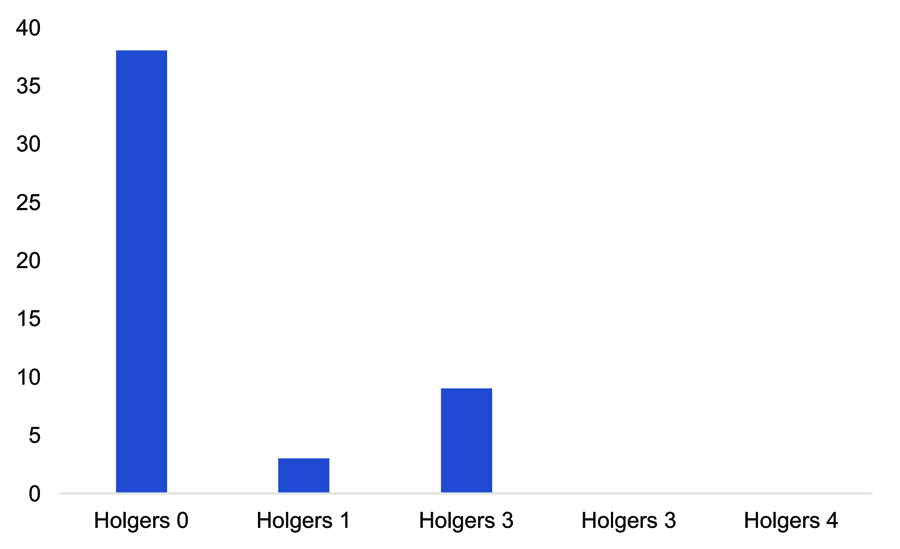
Figura 3. Complicaciones cutáneas en la edad adulta
De los pacientes que presentaron alguna complicación local, dos tenían diagnóstico de eccema irritativo y uno de psoriasis, sin manifestar otras enfermedades cutáneas. Todos los pacientes cumplían con el espesor mínimo requerido para la colocación del pedestal según mediciones realizadas en imágenes de TAC (2,5 mm), por lo que no se ha considerado como un factor determinante en la aparición de complicaciones locales en nuestra muestra (Tjellström et al., 2001).
Discusión
Hemos encontrado una tasa de complicaciones locales baja (el 26,31%) empleando implantes de conducción ósea percutáneos, siendo la mayoría de ellas (el 93,33%) leves. Sin embargo, esta tasa de complicaciones cutáneas se eleva en población pediátrica hasta alcanzar un 42% de los pacientes. En la revisión sistemática publicada por Lagerkvist et al. (2020) se estudia el dispositivo de conducción ósea percutáneo Ponto®. Se describe una tasa de reacciones adversas locales Holgers ≥2 en un 15% (133/863) de los pacientes, si bien no todos los estudios recogían este dato. No se informa acerca de complicaciones potencialmente mortales (Lagerkvist et al., 2020), lo cual coincide con los datos obtenidos en la revisión sistemática realizada por Schwab et al. (2020) de un total de 234 artículos, en el que la tasa de acontecimientos adversos con relación al número de oídos fue de dos (28,6%) para dispositivos Ponto® y de 44 (37,6%) para dispositivos de tipo Baha® Connect, sin analizar si estas diferencias son estadísticamente significativas. Schwab et al. (2020) también detallan la incidencia de acontecimientos adversos usando el parámetro del cociente de acontecimientos por oído (REE) de manera independiente para cinco categorías (relativas al dispositivo, a la piel, a la cirugía, al paciente y no especificadas). Se detectaron un total de 204 acontecimientos adversos diferentes, siendo los más frecuentes para dispositivos de tipo Baha® Connect: grado 1 de Holgers (REE de 0,07), grado 2 de Holgers (REE de 0,05) y cirugía de revisión cutánea por sobrecrecimiento (REE de 0,04). Los datos analizados demostraron que la tasa de complicaciones es muy baja con ambos dispositivos y que no son comparables por ser cualitativamente diferentes (Schwab et al., 2020). Los resultados obtenidos se encuentran en concordancia con nuestro estudio, en el que las complicaciones más frecuentes encontradas han sido grados 1 y 2 de Holgers (el 82,35%).
El metaanálisis publicado por Kiringoda y Lustig (2013) describe las complicaciones locales cutáneas como las más comunes. Tras recopilar 21 trabajos se encontró una tasa de complicaciones en población adulta y mixta que oscila entre el 2,4%-38,1% para Holgers <4 y de 0,4%-4,8% para complicaciones de grado 4 de Holgers. Un único estudio que incluyó pacientes pediátricos notifica una tasa de complicaciones globales del 89% y complicaciones Holgers ≥2 del 77,8% en 27 pacientes (Kraai et al., 2011). Otros estudios publicados describen la tasa de extrusión del implante en la población pediátrica entre el 5,3% y el 26% (Dun et al., 2012). Las complicaciones más frecuentes en edad pediátrica son la pérdida del tornillo y el desarrollo de complicaciones cutáneas, dado que se produjo la pérdida de tornillo hasta en el 14% de la población estudiada y fue hasta del 71% en niños menores de 5 años (Roman et al., 2011). Estos resultados coinciden con el estudio retrospectivo publicado por de Wolf et al. (2008) en el que se describe una pérdida del implante hasta en el 16,3% de la población pediátrica (21/129), la mayoría producidas en el primer año tras la intervención quirúrgica.
En los estudios de den Besten et al. (2015) y Dun et al. (2012) se consideran las enfermedades cutáneas o los trastornos graves del aprendizaje como factores de riesgo para el desarrollo de complicaciones cutáneas; por el contrario, el sexo femenino se considera un factor de riesgo negativo o protector. En nuestro estudio no hemos considerado los factores de riesgo. Siau et al. (2016) describen los principales motivos por los que los pacientes rechazan la colocación del Baha®; de 98 pacientes con indicación de colocación, únicamente en el 38,8% de los casos se llevó a cabo la intervención quirúrgica. El 45% alegaron ansiedad ante la cirugía y el 30% cuestiones estéticas. Este motivo es uno de los principales factores que explican el hecho de que esté en boga la colocación de dispositivos transcutáneos, que mantienen la integridad de la superficie cutánea; sin embargo, su tasa de complicaciones no es nula (de Souza et al., 2022).
Aunque los dispositivos transcutáneos pasivos ocasionan una tasa menor de complicaciones cutáneas, la fuerza magnética que se requiere para mantener el dispositivo externo en su lugar correcto y que la transmisión del sonido sea correcta puede provocar dolor e irritación local hasta alcanzar la necrosis por isquemia en los casos más extremos (Chen et al., 2017; Ellsperman et al., 2021). La revisión sistemática de Cooper et al. (2017) informa de una tasa de complicaciones cutáneas leves del 13,1% que se resolvieron con el uso de un imán menos potente (Cooper et al., 2017; Ellsperman et al., 2021). En la revisión sistemática publicada por de Souza et al., (2022) se describen un total de 192 acontecimientos adversos en relación con la implantación de 901 dispositivos transcutáneos (el 21,3%). Se catalogaron como menores en el 84,3% y mayores en el 16,1%. La tasa de complicaciones menores relacionadas con la implantación transcutánea se sitúa en torno al 20%, datos similares a la tasa de complicaciones de implantación percutánea.
La técnica de incisión arciforme con conservación de tejido y colocación del implante externo fue la empleada en nuestro estudio; ésta pretende evitar complicaciones, como el sobrecrecimiento bacteriano, que pueden llevar a la aparición de complicaciones locales. En el estudio retrospectivo publicado por Strijbos et al. (2022) se compara la técnica de incisión lineal con conservación de tejido (LITT-P) con la incisión de forma estrellada mínimamente invasiva (SSI). No se detectaron complicaciones intraoperatorias, pero la tasa de complicaciones cutáneas fue menor con la técnica LITT-P (17 frente a 21 Holgers 1, y 10 frente a 16 Holgers 2). Estos resultados concuerdan con la revisión sistemática publicada por Mohamad et al. (2016) que incluye 30 estudios en los que se compara la tasa de complicaciones en función de la técnica quirúrgica empleada. El uso de la técnica de incisión lineal notificó menos complicaciones que el uso del dermatomo (Mohamad et al., 2016; Tamarit Conejeros et al., 2009). En nuestro estudio se empleó la misma técnica quirúrgica en todos los casos, por lo que no podemos comparar la tasa de complicaciones.
El coste de los dispositivos de conducción ósea puede variar en función del modelo específico, la complejidad del dispositivo, el tipo de procesador o los accesorios incluidos (Olsen et al., 2011). No es un factor que influya en la aparición de complicaciones cutáneas, pero a nuestro modo de ver el coste económico es un aspecto que debe tenerse en cuenta a la hora de hacer nuestra elección, especialmente en un centro sanitario público. La tasa de complicaciones varía en función de la técnica quirúrgica, la experiencia del cirujano o los factores precipitantes de los pacientes (den Besten et al., 2015; Ellsperman et al., 2021; Kiringoda y Lustig, 2013). El porcentaje de complicaciones importantes es bajo y no justifica por sí mismo un cambio en la indicación de los dispositivos (Ellsperman et al., 2021). Las técnicas que siguen el principio de conservación de tejido, como la usada en nuestro estudio, son seguras con una incidencia baja de infecciones postoperatorias en el seguimiento a corto y largo plazo (Verheij et al., 2016).
Como limitaciones de nuestro estudio caben mencionarse la heterogeneidad de la muestra, su pequeño tamaño y la falta de estudio de factores de riesgo. La comparación entre diferentes técnicas quirúrgicas (método quirúrgico mínimamente invasivo [MIPS] frente a incisión con levantamiento de colgajo) o el análisis de las tasas de complicación en función del dispositivo de conducción por vía ósea utilizado requieren estudios más amplios, con un mayor número de pacientes. Para ello nos planteamos realizar un estudio multicéntrico.
Conclusiones
La elección del dispositivo osteointegrado se debe decidir en base a la capacidad de amplificación del dispositivo, los motivos económicos y las complicaciones notificadas en cada centro. El porcentaje de complicaciones graves es muy bajo y no justificaría per se la sustitución de los dispositivos percutáneos por transcutáneos en los casos en que la indicación de estos dispositivos sea para evitar complicaciones locales.
Agradecimientos
Los autores manifiestan su agradecimiento al Dr. José Luis Castillo por su asesoramiento en aspectos metodológicos.
Bibliografía
Brånemark, R., Brånemark, P. I., Rydevik, B., & Myers, R. R. (2001). Osseointegration in skeletal reconstruction and rehabilitation: a review. J Rehabil Res Dev., 38(2), 175–181.
Brenner, M. J., Goebel, J. A., & Wippold, F. J., 2nd (2007). Insufficient cranial thickness in bone-anchored hearing aid placement. Otology & neurotology: official publication of the American Otological Society, American Neurotology Society [and] European Academy of Otology and Neurotology, 28(6), 865–866. https://doi.org/10.1097/MAO.0b013e318030b042
Calon, T. G. A., Johansson, M. L., de Bruijn, A. J. G., van den Berge, H., Wagenaar, M., Eichhorn, E., Janssen, M. M. L., Hof, J. R., Brunings, J. W., Joore, M. A., Jonhede, S., van Tongeren, J., Holmberg, M., & Stokroos, R. J. (2018). Minimally invasive ponto surgery versus the linear incision technique with soft tissue preservation for bone conduction hearing implants: A multicenter randomized controlled trial. Otol Neurotol., 39(7), 882–893. https://doi.org/10.1097/MAO.0000000000001852
Cass, S. P., & Mudd, P. A. (2010). Bone-anchored hearing devices: indications, outcomes, and the linear surgical technique. Oper Tech Otolaryngol Head Neck Surg;21:197–206. https://doi.org/10.1016/j.otot.2010.05.004
Chen, S. Y., Mancuso, D., & Lalwani, A. K. (2017). Skin necrosis after implantation with the BAHA attract: A case report and review of the literature. Otol Neurotol., 38(3), 364–367. https://doi.org/10.1097/MAO.0000000000001327
Cooper, T., McDonald, B., & Ho, A. (2017). Passive transcutaneous bone conduction hearing implants: A systematic review. Otol Neurotol., 38(9), 1225–1232. https://doi.org/10.1097/MAO.0000000000001518
den Besten, C. A., Bosman, A. J., Nelissen, R. C., Mylanus, E. A., & Hol, M. K. (2016). Controlled clinical trial on bone-anchored hearing implants and a surgical technique with soft-tissue preservation. Otol Neurotol., 37(5), 504–512. https://doi.org/10.1097/MAO.0000000000000994
den Besten, C. A., Nelissen, R. C., Peer, P. G., Faber, H. T., Dun, C. A., de Wolf, M. J., Kunst, H. P., Cremers, C. W., Mylanus, E. A., & Hol, M. K. (2015). A retrospective cohort study on the influence of comorbidity on soft tissue reactions, revision surgery, and implant loss in bone-anchored hearing implants. Otol Neurotol., 36(5), 812–818. https://doi.org/10.1097/MAO.0000000000000745
de Souza, M. A., Vallejos Riart, S. L., Souza, S. R., de Brito, R., & Bento, R. F. (2022). Complications of transcutaneous protheses - A systematic review of publications over the past 10 years. Int Arch Otorhinolaryngol., 26(3), e505–e512. https://doi.org/10.1055/s-0042-1742352
de Wolf, M. J., Hol, M. K., Huygen, P. L., Mylanus, E. A., & Cremers, C. W. (2008). Nijmegen results with application of a bone-anchored hearing aid in children: simplified surgical technique. Ann Otol, Rhinol Laryngol., 117(11), 805–814. https://doi.org/10.1177/000348940811701103
Dufour-Fournier, C., Devèze, A., Barbut, J., Ogam, E., Saliba, I., & Masson, C. (2022). Analysis of the acoustic transcranial bone conduction. Audiol Res., 12(2), 162–170. https://doi.org/10.3390/audiolres12020019
Dun, C. A., Faber, H. T., de Wolf, M. J., Mylanus, E. A., Cremers, C. W., & Hol, M. K. (2012). Assessment of more than 1,000 implanted percutaneous bone conduction devices: skin reactions and implant survival. Otol Neurotol., 33(2), 192–198. https://doi.org/10.1097/MAO.0b013e318241c0bf
Ellsperman, S. E., Nairn, E. M., & Stucken, E. Z. (2021). Review of bone conduction hearing devices. Audiol Res., 11(2), 207–219. https://doi.org/10.3390/audiolres11020019.
Johansson, M. L., Stokroos, R. J., Banga, R., Hol, M. K., Mylanus, E. A., Savage Jones, H., Tysome, J. R., Vannucchi, P., Hof, J. R., Brunings, J. W., van Tongeren, J., Lutgert, R. W., Banerjee, A., Windfuhr, J. P., Caruso, A., Giannuzzi, A. L., Bordin, S., Hanif, J., Schart-Morén, N., … Hultcrantz, M. (2017). Short-term results from seventy-six patients receiving a bone-anchored hearing implant installed with a novel minimally invasive surgery technique. Clin Otolaryngol., 42(5), 1043–1048. https://doi.org/10.1111/coa.12803
Kiringoda, R., & Lustig, L. R. (2013). A meta-analysis of the complications associated with osseointegrated hearing aids. Otol Neurotol., 34(5), 790–794. https://doi.org/10.1097/MAO.0b013e318291c651.
Kraai, T., Brown, C., Neeff, M., & Fisher, K. (2011). Complications of bone-anchored hearing aids in pediatric patients. Int J Pediatr Otorhinolaryngol., 75(6), 749–753. https://doi.org/10.1016/j.ijporl.2011.01.018
Lagerkvist, H., Carvalho, K., Holmberg, M., Petersson, U., Cremers, C., & Hultcrantz, M. (2020). Ten years of experience with the Ponto bone-anchored hearing system: A systematic literature review. Clin Otolaryngol., 45(5), 667–680. https://doi.org/10.1111/coa.13556
Lavilla Martín de Valmaseda, M. J., Cavalle Garrido, L., Huarte Irujo, A., Núñez Batalla, F., Manrique Rodriguez, M., Ramos Macías, Á., de Paula Vernetta, C., Gil-Carcedo Sañudo, E., Lassaletta, L., Sánchez-Cuadrado, I., Espinosa Sánchez, J. M., Batuecas Caletrio, Á., & Cenjor Español, C. (2019). Clinical guideline on bone conduction implants. Guía clínica sobre implantes de conducción de vía ósea. Acta Otorrinolaringol Esp (Engl Ed)., 70(2), 105–111. https://doi.org/10.1016/j.otorri.2017.12.001
Mohamad, S., Khan, I., Hey, S. Y., & Hussain, S. S. (2016). A systematic review on skin complications of bone-anchored hearing aids in relation to surgical techniques. Eur Archs Otorhinolaryngol., 273(3), 559–565. https://doi.org/10.1007/s00405-014-3436-1
Olsen, S. Ø., Glad, H., & Nielsen, L. H. (2011). Comparison between two bone-anchored hearing instruments: BP100 and Ponto Pro. Int. J. Audiol, 28(8), 1107–1112. https://doi.org/10.3109/14992027.2011.605806
Reinfeldt, S., Håkansson, B., Taghavi, H., & Eeg-Olofsson, M. (2015). New developments in bone-conduction hearing implants: a review. Medical devices (Auckland, N.Z.), 8, 79–93. https://doi.org/10.2147/MDER.S39691
Roman, S., Nicollas, R., & Triglia, J. M. (2011). Practice guidelines for bone-anchored hearing aids in children. Eur Ann Otorhinolaryngol Head Neck Dis., 128(5), 253–258. https://doi.org/10.1016/j.anorl.2011.04.005
Schwab, B., Wimmer, W., Severens, J. L., & Caversaccio, M. D. (2020). Adverse events associated with bone-conduction and middle-ear implants: A systematic review. Eur Archs Otorhinolaryngol., 277(2), 423–438. https://doi.org/10.1007/s00405-019-05727-8
Siau, R. T., Dhillon, B., Siau, D., & Green, K. M. (2016). Bone-anchored hearing aids in conductive and mixed hearing losses: why do patients reject them?. Eur Archs Otorhinolaryngol., 273(10), 3117–3122. https://doi.org/10.1007/s00405-016-3941-5
Strijbos, R. M., Salameh, S., Bezdjian, A., Daniel, S. J., & Thomeer, H. G. (2022). The minimally invasive star-shaped incision technique and the linear incision technique with tissue preservation for percutaneous bone conduction devices: A Retrospective cohort study. Front Surg., 9, 863997. https://doi.org/10.3389/fsurg.2022.863997
Tamarit Conejeros, J. M., Dalmau Galofre, J., Murcia Puchades, V., Pons Rocher, F., Fernández Martínez, S., & Estrems Navas, P. (2009). Comparison of skin complications between dermatome and U-graft technique in BAHA surgery. Acta Otorrinolaringol Esp (Engl Ed)., 60(6), 422–427. https://doi.org/10.1016/j.otorri.2009.06.005
Tjellström, A., Håkansson, B., & Granström, G. (2001). Bone-anchored hearing aids: current status in adults and children. Otolaryngologic clinics of North America, 34(2), 337–364. https://doi.org/10.1016/s0030-6665(05)70335-2
Tjellström, A., Lindström, J., Hallén, O., Albrektsson, T., & Brånemark, P. I. (1981). Osseointegrated titanium implants in the temporal bone. A clinical study on bone-anchored hearing aids. Am J Otol., 2(4), 304–310.
Verheij, E., Bezdjian, A., Grolman, W., & Thomeer, H. G. (2016). A Systematic Review on Complications of Tissue Preservation Surgical Techniques in Percutaneous Bone Conduction Hearing Devices. Otol Neurotol., 37(7), 829–837. https://doi.org/10.1097/MAO.0000000000001091
Verstraeten, N., Zarowski, A. J., Somers, T., Riff, D., & Offeciers, E. F. (2009). Comparison of the audiologic results obtained with the bone-anchored hearing aid attached to the headband, the testband, and to the "snap" abutment. Otol Neurotol., 30(1), 70–75. https://doi.org/10.1097/MAO.0b013e31818be97a
Yuen, H. W., Bodmer, D., Smilsky, K., Nedzelski, J. M., & Chen, J. M. (2009). Management of single-sided deafness with the bone-anchored hearing aid. Otolaryngol Head Neck Surg., 141(1), 16–23. https://doi.org/10.1016/j.otohns.2009.02.029
Zernotti, M. E., & Sarasty, A. B. (2015). Active bone conduction prosthesis: Bonebridge(TM). Arch Otorhinolaryngol., 19(4), 343–348. https://doi.org/10.1055/s-0035-1564329
Conflicto de intereses
Los autores declaran no tener ningún conflicto de interés.
Autorización ética y consentimiento informado
Este estudio se llevó a cabo siguiendo las directrices de la declaración de Helsinki. Todos los pacientes incluidos en el estudio firmaron el consentimiento informado correspondiente.
Contribuciones de los autores
MNG: Adquisición de datos. Investigación. Análisis e interpretación de datos. Redacción del borrador original. JCJ: Adquisición de datos. Análisis e interpretación de datos. Investigación. FFN: Adquisición de datos. Recursos materiales. Investigación. Supervisión. JME: Redacción (revisión y edición). Validación. JGV: Conceptualización. Investigación. Análisis e interpretación de datos.
Cómo citar:
Núñez-Gutiérrez, M., Castro-Jiménez, J., Fernández-Nogueras Jiménez, F., Espinosa-Sánchez, J.M., García-Valdecasas, J. (2023).
Complicaciones en osteointegración percutánea: ¿justifican realmente una disminución en su uso? Auditio, 7, e89.
https://doi.org/10.51445/sja.auditio.vol7.2023.0089
Correspondencia
Marta Núñez Gutiérrez
Secretaría ORL, Hospital Universitario Virgen de las Nieves (HUVN), Av. de las Fuerzas Armadas, 2, 18014, Granada. España.
Email: martangutierrez@hotmail.es
Oficina Editorial
Corrección: Tomás Pérez Pazos
Traducción: Emma Goldsmith
Revisión traducción: Carlos R. Benítez-Barrera
Producción: Glaux Publicaciones Académicas