 1,2,3, Jose M. Bermúdez-Muñoz
1,2,3, Jose M. Bermúdez-Muñoz 1,2, Carmen Ruiz-García
1,2, Carmen Ruiz-García 4, Luis Lassaletta2,4,5, Julio Contreras
4, Luis Lassaletta2,4,5, Julio Contreras 1,2,6, Silvia Murillo-Cuesta
1,2,6, Silvia Murillo-Cuesta 1,2,5* e Isabel Varela-Nieto
1,2,5* e Isabel Varela-Nieto 1,2,5
1,2,5Artículos de Investigación
Bases genéticas, moleculares y bioquímicas del envejecimiento auditivo. ¿Qué nos enseñan los modelos experimentales?
Blanca Cervantes 1,2,3, Jose M. Bermúdez-Muñoz
1,2,3, Jose M. Bermúdez-Muñoz 1,2, Carmen Ruiz-García
1,2, Carmen Ruiz-García 4, Luis Lassaletta2,4,5, Julio Contreras
4, Luis Lassaletta2,4,5, Julio Contreras 1,2,6, Silvia Murillo-Cuesta
1,2,6, Silvia Murillo-Cuesta 1,2,5* e Isabel Varela-Nieto
1,2,5* e Isabel Varela-Nieto 1,2,5
1,2,5
1Instituto de Investigaciones Biomédicas Alberto Sols CSIC-UAM, Madrid, España / 2Centro de Investigación Biomédica en Red, Instituto de Salud Carlos III, Madrid, España / 3Facultad de Medicina, Universidad Anáhuac, Puebla, México / 4Servicio ORL, Hospital Universitario La Paz, Madrid, España / 5Instituto de Investigación Hospital Universitario La Paz, Madrid, España / 6Facultad de Veterinaria, Universidad Complutense de Madrid, Madrid, España
 OPEN ACCESS
OPEN ACCESS
PEER REVIEWED
PERSPECTIVAS
Resumen
La presbiacusia afecta a una de cada tres personas mayores de 65 años y constituye el déficit neurosensorial más prevalente. Antecede a la aparición de la fragilidad cognitiva, la acelera y se asocia con un mayor riesgo de padecer enfermedades neurodegenerativas como la demencia o el Alzheimer. La aparición y evolución de la presbiacusia están influidas por factores genéticos, todavía poco conocidos, y ambientales, entre los que destacan la exposición a ruido excesivo o a sustancias ototóxicas. En la actualidad no disponemos de tratamientos farmacológicos eficaces para prevenir o tratar la presbiacusia, por lo que la investigación en este campo es prioritaria. En este contexto, los modelos animales son una herramienta esencial para: a) identificar nuevos genes de presbiacusia, b) comprender las bases celulares y moleculares del envejecimiento auditivo, y c) definir nuevas dianas terapéuticas y evaluar posibles tratamientos.
Palabras clave
Presbiacusia; apoptosis; estrés oxidativo; neuroinflamación; modelos animales.
Implicaciones clínicas
La presbiacusia es una enfermedad compleja y de origen multifactorial que afecta a una parte de la población —los mayores de 65 años—, la cual aumentará de manera notable en las próximas décadas en los países desarrollados. Dificulta seriamente la capacidad de comunicación de los mayores y afecta gravemente a la calidad de vida de los pacientes. Además, se ha descrito una clara asociación con el desarrollo de enfermedades neurodegenerativas como la demencia senil o el Alzheimer. Los tratamientos disponibles actualmente (audífonos o implantes cocleares) son costosos e inasequibles para muchos pacientes, mientras que los tratamientos farmacológicos (preventivos o curativos) se encuentran aún en fase de investigación preclínica o clínica. Por todo ello, la presbiacusia, como otras dolencias geriátricas, constituye un desafío importante para la biomedicina y para el sistema sanitario.
Recibido: 10.04.2022 Revisado: 04.06.2022 Aceptado: 06.07.2022 Publicado: 01.09.2022
Editado por:
Gerard Encina-Llamas,
Universidad Técnica de Dinamarca, Dinamarca
Revisado por:
Jordi Llorens,
Universidad de Barcelona, España.
Ignacio del Castillo Fernández del Pino,
Hospital Universitario Ramón y Cajal, España.
Patricia Vázquez,
Fundación Vinjoy, España.
Introducción
Según datos facilitados por la Organización Mundial de la Salud (OMS), un 20% de la población mundial presenta algún tipo de pérdida auditiva, y un 6,1% —unos 466 millones de personas— padece una pérdida auditiva incapacitante (WHO, 2021). Se estima que el coste global anual derivado de no tratarla adecuadamente es de 980 mil millones de USD, cifra que se obtiene sumando los gastos sanitarios (sin contar los dispositivos auditivos), de apoyo educativo, la pérdida de productividad y los costes sociales. Especialmente preocupantes son la hipoacusia por ruido (se estima que más de mil millones de jóvenes entre 12 y 35 años están en riesgo de sufrirla por exposición a ruido recreativo) y la presbiacusia, debido al envejecimiento de la población mundial (WHO, 2021).
Se considera que una persona tiene pérdida de audición o hipoacusia si presenta una pérdida tonal media superior a 25 dB HL en el oído con mejor audición (Olusanya, Davis & Hoffman, 2019). La hipoacusia puede ser leve, moderada, grave o profunda y puede afectar a uno o a ambos oídos. Las principales formas clínicas de pérdida auditiva incluyen: a) hipoacusia congénita o de aparición temprana, causada por defectos genéticos, infecciones durante el embarazo o complicaciones en el parto; b) hipoacusia por infecciones crónicas del oído medio; c) hipoacusia inducida por exposición al ruido o a fármacos ototóxicos que dañan el oído interno; y d) la pérdida auditiva relacionada con el envejecimiento.
Las consecuencias de la pérdida auditiva son diversas y dependen del grado de afectación y del momento de aparición, llegando a ser incapacitantes. En niños produce ausencia o retraso en el desarrollo del lenguaje y disminuye su rendimiento académico, mientras que en adultos dificulta el desarrollo social y profesional. En las personas mayores, la hipoacusia merma la capacidad para comunicarse con los demás, lo que conduce al aislamiento social, la soledad y la depresión. De hecho, la pérdida auditiva se asocia con una mayor fragilidad cognitiva y con una progresión más rápida de las enfermedades neurodegenerativas (Kim, Lim, Kong & Choi, 2018). Situaciones excepcionales como la pandemia de COVID-19 han venido a entorpecer aún más la comunicación para las personas con pérdida auditiva debido a que las mascarillas impiden la lectura de labios, como han denunciado en España FIAPAS (Confederación Española de Familias de Personas Sordas) y la CNSE (Confederación Estatal de Personas Sordas).
Discusión
El envejecimiento en los seres humanos es un proceso fisiológico caracterizado por la acumulación gradual y permanente de una amplia variedad de daños moleculares y celulares, lo que produce un deterioro generalizado y progresivo de muchas funciones del cuerpo y mayor susceptibilidad a la enfermedad. Los principales mecanismos fisiopatológicos relacionados con el envejecimiento son la inestabilidad genómica, las alteraciones epigenéticas, la disfunción mitocondrial, la senescencia celular y la pérdida de proteostasis (López-Otín et al., 2013). Las alteraciones morfológicas y funcionales asociadas al envejecimiento afectan a los sistemas cardiovascular, renal, nervioso y muscular, entre otros. Con la edad también se producen alteraciones estructurales y funcionales en el oído que dan lugar a la presbiacusia.
La presbiacusia o hipoacusia asociada a la edad (ARHL, del inglés age-related hearing loss) es la pérdida de la capacidad auditiva que se desarrolla a medida que envejecemos. Afecta a un tercio de la población de más de 65 años y a la mitad de las personas por encima de los 75 (WHO, 2021). Debido al incremento en la esperanza de vida y al envejecimiento global de la población, la presbiacusia constituye un importante desafío para el sistema sanitario en las próximas décadas.
La presbiacusia se manifiesta inicialmente con una pérdida de sensibilidad para detectar frecuencias altas que progresa hacia las frecuencias más bajas, lo cual entorpece la capacidad para seguir una conversación, especialmente en ambientes ruidosos. Esta situación disminuye sensiblemente la capacidad de comunicación, la calidad de vida y la independencia de las personas mayores, quienes tienden a aislarse del entorno y a recibir menos estímulos, lo que unido al envejecimiento del propio cerebro, favorece el deterioro cognitivo y el desarrollo de enfermedades neurodegenerativas como la demencia senil y el Alzheimer. Así, se estima que el deterioro cognitivo en personas que no oyen bien es un 40% superior al de aquellas con buena capacidad auditiva (Panza, Solfrizzi & Logroscino, 2015).
Una solución eficaz para tratar la presbiacusia y reducir la fragilidad cognitiva es el uso de audífonos, que aumentan la intensidad de los sonidos que recibimos, o de implantes cocleares, que estimulan directamente a las terminaciones nerviosas en el oído interno. Las personas que utilizan estos dispositivos reducen considerablemente la pérdida de memoria auditiva, mejoran la interacción social y, en definitiva, disminuyen el deterioro cognitivo asociado a la edad (Calvino et al., 2022; Maharani et al., 2018).
La presbiacusia es una enfermedad de causa multifactorial en la que intervienen factores ambientales, genéticos y epigenéticos (Wang & Puel, 2020). El factor ambiental que más contribuye a acelerar la presbiacusia es el ruido: la exposición crónica a ruido profesional o recreativo produce daño mecánico, especialmente en las células ciliadas, así como alteraciones metabólicas derivadas de la hipoxia por vasoconstricción de capilares en la estría vascular (Liberman, 2017). Otro factor externo es la exposición a tratamientos prolongados con fármacos potencialmente ototóxicos, entre los que destacan los antibióticos aminoglucósidos, antitumorales derivados del platino, diuréticos como la furosemida o algunos antiinflamatorios como la aspirina (Joo et al., 2020). La presbiacusia también se ha asociado a la presencia de otras enfermedades crónicas frecuentes en edades avanzadas como la diabetes, las alteraciones cardiovasculares, los microinfartos o el cáncer, entre otros (Besser, Stropahl, Urry & Launer, 2018). El estilo de vida (dieta, hábito tabáquico, etc.) también contribuye al desarrollo de la presbiacusia, modulando el fenotipo y aumentando la heterogeneidad clínica de la enfermedad. Así, las carencias nutricionales durante el envejecimiento aceleran la presbiacusia, aunque no está claro si es un síntoma, un desencadenante o ambos (Partearroyo, Vallecillo, Pajares, Varela-Moreiras & Varela-Nieto, 2017).
Además de factores extrínsecos, existe un importante componente genético no del todo conocido que contribuye a la pérdida auditiva, sensibilizando las células neurosensoriales del órgano auditivo al daño. El factor genético es el que mejor explica la variabilidad entre sujetos con estilos de vida similares, y se estima que podría contribuir entre un 40%-70% al desarrollo de presbiacusia, según estudios realizados en gemelos (Momi, Wolber, Fabiane, MacGregor & Williams, 2015). Los factores epigenéticos, tales como alteraciones en la metilación del ADN o modificaciones proteicas en las histonas, están cobrando cada vez más relevancia en las afecciones asociadas al envejecimiento, como la presbiacusia (Kuo, Moore, Lin & Ferrucci, 2021).
La identificación de los genes que determinan la susceptibilidad y progresión de la presbiacusia resulta clave para realizar un diagnóstico temprano e instaurar tratamientos preventivos que reduzcan la pérdida irreversible de las estructuras responsables de la audición. Sin embargo, a pesar de los numerosos estudios de asociación del genoma completo en cohortes de pacientes y muestras de biobancos, así como los ensayos in silico, in vitro y con modelos animales, tan solo se han identificado unos pocos genes (Ivarsdottir et al., 2021; tabla 1).
Tabla 1. Principales genes identificados y candidatos de susceptibilidad a la pérdida auditiva asociada a la edad en Homo sapiens.
Gen |
Función |
Referencia |
Población |
ACVR1B |
Receptor de activina de tipo 1B |
Europea |
|
APOE |
Transporte de lípidos |
Americana |
|
CAT |
Catalasa, enzima antioxidante |
Europea |
|
CCBE1 |
Participa en la linfangiogénesis en vertebrados |
Europea |
|
CDH13 |
Adhesión celular |
Europea |
|
CEP104 |
Ciliogénesis e integridad ciliar |
Europea italiana |
|
CMIP |
Señalización de linfocitos T |
Europea |
|
DLCK1 |
Serina-treonina-quinasa*, señalización |
Europea, (italiana y croata) |
|
EDN1 |
Péptido vasoactivo expresado en células ganglionares |
Japonesa |
|
ESRRG |
Receptor nuclear de hormonas esteroideas |
Europea |
|
EYA4 |
Activador transcripcional, maduración del órgano de Corti |
Europea |
|
FXYD5 |
Regulador de la actividad del canal de sodio |
Europea y americana |
|
GHR |
Receptor de la hormona de crecimiento |
(Attias, Zarchi, Nageris & Laron, 2012; Prado-Barreto et al., 2014) |
Pacientes con síndrome de Laron de Israel; brasileña |
GRLH2 |
Desarrollo epitelial |
Europea y china |
|
GRM7 |
Transmisión sináptica |
Europea y americana |
|
GRM8 |
Transmisión sináptica |
Europea |
|
GSTM1 |
Glutatión-S-transferasas, Destoxificación, antioxidante |
Americana |
|
GSTT1 |
Glutatión-S-transferasas, Destoxificación, antioxidante |
Americana |
|
IGF1 |
Factor de crecimiento similar a la insulina de tipo 1 |
Inglesa |
|
ILDR1 |
Receptor multimérico de membrana |
Europea |
|
IPP |
Interacción con actina |
Europea y americana |
|
IQGAP2 |
Adhesión, motilidad y morfología celular |
Finlandesa y sami |
|
ISG20 |
Exonucleasa |
Europea |
|
ITGA8 |
Adhesión celular |
Europea |
|
KCNMA1 |
Canal de calcio |
Europea |
|
KCNQ1 |
Canal de potasio |
Europea |
|
KCNQ4 |
Canal de potasio |
Americana |
|
MPZL2 |
Molécula de adhesión, interacciones entre células epiteliales |
Europea |
|
mtDNA |
Mutaciones de ADN mitocondrial, mtDNA4977 |
Europea y china |
|
MTHFR |
Metabolismo de la homocisteína, antioxidante |
(Manche, Jangala, Dudekula, Koralla & Akka, 2018; Uchida, Sugiura, Ando, Nakashima & Shimokata, 2011) |
India Japonesa |
MTR |
Metabolismo de la homocisteína, antioxidante |
Japonesa |
|
NAT2 |
Destoxificación, antioxidante |
General europea; Turca |
|
PCDH15 |
Estructura de los estereocilios |
Europea |
|
PCDH20 |
Adhesión celular |
Italiana aislada y Silk Road |
|
PTPRD |
Receptor de tirosina-fosfatasa δ |
Europea |
|
PRKCE |
Proteína-quinasa, relacionada con la vía de NRF2 |
Europea y Asia central |
|
SIK3 |
Quinasa, regulador positivo de mTOR |
Europea Silk Road |
|
SLC28A3 |
Transportador concentrador de nucleósidos |
Italiana aislada y Silk Road |
|
SLC44A2 |
Transportador de colina |
Europea |
|
SLC7A8 |
Transportador de aminoácidos neutros |
Italiana aislada |
|
SOD2 |
Superóxido-dismutasa 2, enzima antioxidante |
Europea |
|
SPIRE2 |
Transporte intracelular de vesículas a través de filamentos de actina |
Europea y americana |
|
SPTBN1 |
Secreción, movimiento del citoesqueleto en la membrana dependiente de calcio |
Europea y americana |
|
STRN |
Proteína de unión a la calmodulina |
Europea |
|
TFGB1 |
Respuesta inmunitaria |
Europea y Asia central |
|
TNF |
Respuesta inmunitaria |
Japonesa |
|
TNFRSF1B |
Respuesta inmunitaria |
Japonesa |
|
TRIL |
Respuesta inmunitaria al LPS, componente del complejo de señalización TLR4 |
Europea y americana |
|
TRIOBP |
Organización del citoesqueleto, motilidad celular |
Europea |
|
UCP2 |
Transportador de protones mitocondrial |
Japonesa |
|
WFS1 |
Proteína transmembranaria en el retículo endoplásmico, canal selectivo de cationes |
Finesa |
|
* quinasa, o también cinasa. En inglés, kinase. |
|||
La complejidad anatómica y funcional de la cóclea explica que variantes en genes de muy diversa naturaleza puedan asociarse con una mayor predisposición a desarrollar pérdida auditiva asociada a la edad. Así, una parte importante de los genes identificados incluye genes relacionados con la mecanotransducción, la recirculación del potasio, las uniones celulares o la transmisión sináptica. También observamos genes que participan en procesos desregulados durante el envejecimiento como el estrés oxidativo, la inflamación o la función mitocondrial, y cuya participación ha sido descrita en otras dolencias seniles (aterosclerosis, cáncer, cataratas, osteoporosis, diabetes de tipo 2, hipertensión y enfermedad de Alzheimer, entre otras).
La cóclea está constituida por un conducto membranoso enrollado en espiral y dividido en tres compartimentos o escalas llenas de líquido (figura 1). En la escala media se encuentra el órgano de Corti, que contiene las células ciliadas, encargadas de transformar las vibraciones en señales nerviosas recogidas por las neuronas del ganglio espiral. En la pared lateral encontramos la estría vascular, esencial para la homeostasis iónica de la endolinfa.
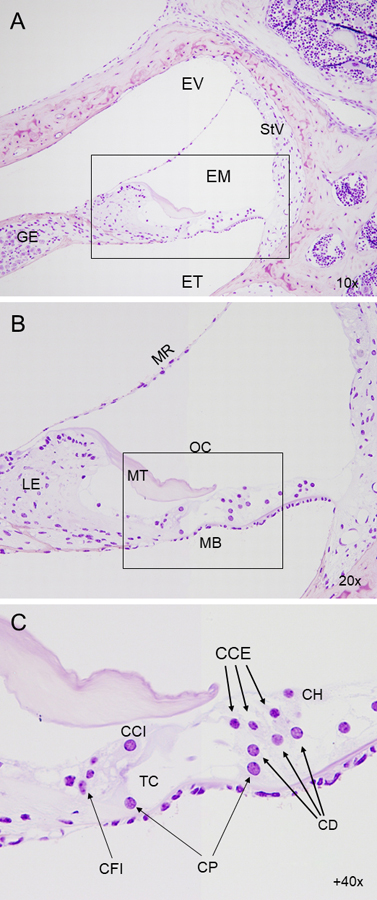
Figura 1. Citoarquitectura del oído interno. Cortes de historresina de cóclea de ratón, contrastados con tinción de Nissl. (A) Microfotografía de un corte transversal del conducto coclear en ratón silvestre, mostrando las tres escalas (vestibular, media y timpánica). (B) Detalle de la escala media, que contiene el órgano de Corti, encargado de la mecanotransducción. (C) Magnificación del órgano de Corti, formado por una fila de células ciliadas internas y tres filas de células ciliadas externas separadas por el túnel de Corti. Las células ciliadas se sustentan sobre un conjunto de células de soporte apoyadas a su vez sobre la membrana basilar. EV: escala vestibular, EM: escala media, ET: escala timpánica, GE: ganglio espiral, StV: stria vascularis, MB: membrana basilar, MT: membrana tectoria, MR: membrana de Reissner, LE: limbo espiral, OC: órgano de Corti, CCI: célula ciliada interna, CCE: célula ciliada externa, CFI: célula falángica interna, CP: célula pilar, CD: célula de Deiters, CH: célula de Hensen, TC: túnel de Corti.
Desde el punto de vista de la fisiopatología, la pérdida auditiva asociada al envejecimiento se ha clasificado tradicionalmente en tres tipos principales, en función de la estructura afectada: a) presbiacusia sensorial, caracterizada por la pérdida de células ciliadas del órgano de Corti; b) presbiacusia estrial o metabólica, provocada por la atrofia de la estría vascular; c) presbiacusia neural, ocasionada por la atrofia del ganglio espiral y degeneración del nervio auditivo (Schuknecht & Gacek, 1993). Sin embargo, en la mayoría de los casos de presbiacusia la afectación es mixta.
Los mecanismos celulares que conducen a la presbiacusia son diversos y comunes a otros órganos cuya funcionalidad se altera con el envejecimiento, e incluyen la inestabilidad de los genes y proteínas, la disfunción de orgánulos celulares, la alteración de los procesos de nutrición y comunicación celular o la pérdida de la capacidad regenerativa (López-Otín, Blasco, Partridge, Serrano & Kroemer, 2013). A diferencia de las aves y de los reptiles, los mamíferos no son capaces de regenerar las células ciliadas, por lo que, cuando las lesiones se repiten, se produce su muerte irreparable e irreversible. Los tratamientos regenerativos en la hipoacusia van encaminados a modular las vías moleculares que inducen la proliferación y diferenciación de las células de soporte en células ciliadas, permitiendo su regeneración (Rai, Tu, Frank & Zuo, 2021).
Respecto a los mecanismos moleculares de la presbiacusia, la inflamación y el estrés oxidativo son los que han recibido una mayor atención y generado un mayor número de dianas terapéuticas. Durante el envejecimiento se instaura una inflamación crónica de baja intensidad y una alteración de la actividad de las células del sistema inmunitario. Así, diferentes estudios han encontrado una clara asociación entre el incremento de umbrales auditivos con la edad y el aumento en el número de macrófagos activados, la sobreexpresión de genes inflamatorios y las citocinas proinflamatorias en la cóclea (Paplou, Schubert & Pyott, 2021).
El estrés oxidativo se produce cuando se altera el balance entre la cantidad de especies reactivas de oxígeno y nitrógeno, y las defensas antioxidantes de la célula, principalmente las enzimas del metabolismo del glutatión. Los radicales libres se generan de manera fisiológica durante la respiración celular en la mitocondria, pero su producción se exacerba por efecto de factores ambientales como el ruido o los ototóxicos. Deficiencias nutricionales, así como ciertos polimorfismos genéticos, pueden disminuir la actividad de las enzimas antioxidantes y contribuir al estrés oxidativo. El exceso de especies reactivas produce daño a las moléculas de ADN, lípidos y proteínas, y activa la muerte celular por apoptosis.
La investigación clínica en pérdida auditiva está muy limitada debido en gran medida a la inaccesibilidad del oído interno, y se sustenta principalmente en la anamnesis del paciente, pruebas electrofisiológicas y, ocasionalmente, técnicas de imagen. Otros procedimientos como la toma de biopsias, la determinación de biomarcadores sanguíneos o el análisis post mortem de muestras de anatomía patológica son, sin embargo, poco habituales. Los modelos experimentales in silico, celulares y, fundamentalmente, animales ha sido clave para: a) conocer la anatomía y la fisiología auditiva, b) entender las bases genéticas y moleculares de la hipoacusia, c) definir dianas terapéuticas y evaluar fármacos que puedan retrasar, reducir o neutralizar las alteraciones patológicas en las células neurosensoriales auditivas durante el envejecimiento, y d) desarrollar pruebas diagnósticas como los potenciales evocados auditivos o las otoemisiones acústicas, y dispositivos como el implante coclear.
El modelo animal más utilizado en investigación auditiva y concretamente en presbiacusia es, sin duda, el ratón de laboratorio (Mus musculus; Bowl & Dawson, 2015). Los ratones tienen una vida media de 2-2,5 años y se consideran modelos de envejecimiento a partir de los 18 meses. A esta edad los ratones presentan síntomas de envejecimiento auditivo similares a los del ser humano, tanto a nivel funcional —aumento de umbrales en frecuencias altas— como morfológico, ya que presentan pérdida de células ciliadas o de neuronas del ganglio espiral (figura 2).
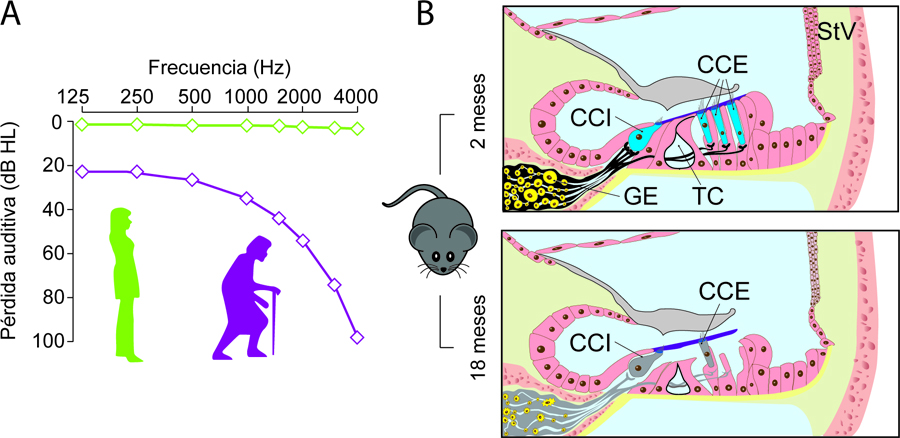
Figura 2. El ratón como modelo para el estudio de la presbiacusia. (A) Diagrama representativo de la pérdida auditiva asociada al envejecimiento. Los individuos jóvenes (línea verde) no presentan pérdidas auditivas en ninguna de las frecuencias estudiadas. Con el envejecimiento (línea morada) se produce un aumento de umbrales auditivos en respuesta a frecuencias altas que se va extendiendo progresivamente a frecuencias más bajas. (B) Los ratones son excelentes modelos para estudiar las alteraciones en la citoarquitectura de la cóclea durante el envejecimiento. En comparación con un ratón joven (2 meses), un ratón de 18 meses presenta pérdida de células ciliadas externas e internas (CCE, CCI), así como de neuronas en el ganglio espiral (GE) y conexiones sinápticas entre ambos tipos celulares. Otras alteraciones habituales son el cierre o colapso del túnel de Corti (TC) y la atrofia de la estría vascular (StV). Estas alteraciones morfológicas aparecen tempranamente en los ratones de estirpe C57BL/6J, modelo clásico para el estudio de la hipoacusia.
Sin embargo, existen estirpes de ratón genéticamente modificadas en las que este proceso se acelera, como los ratones SAMP (Senescence-accelerated mouse prone), los cuales experimentan enfermedades geriátricas tales como osteoporosis, amiloidosis, pérdida de memoria o presbiacusia a edades tempranas (Marie, Larroze-Chicot, Cosnier-Pucheu & Gonzalez-Gonzalez, 2017). También hay ciertas estirpes de ratón que desarrollan de manera precoz presbiacusia aislada (sin otros síntomas), como los ratones C57BL/6J, que presentan una elevación de los umbrales auditivos a partir de los 6 meses de edad. Esta estirpe se ha utilizado como modelo de presbiacusia desde los años 80, aunque no fue hasta dos décadas después cuando se localizó el locus responsable (Ahl1, en el cromosoma 10 del ratón) y se identificó la causa genética, un polimorfismo en el gen Cdh23, que codifica una proteína de las células ciliadas (Noben-Trauth, Zheng & Johnson, 2003).
La generación de ratones modificados genéticamente en los que se anula la acción de un gen (los conocidos como ratones knockout) ha sido fundamental para identificar genes asociados con la aparición de presbiacusia (Bowl & Dawson, 2015). A modo de ejemplo, nuestro grupo ha identificado nuevos genes de predisposición a la presbiacusia en ratones, como Igf1 y Dusp1 (Celaya et al., 2019; Celaya et al., 2021). El factor de crecimiento similar a la insulina tipo 1 (IGF-1) es un factor trófico producido por el hígado cuyos niveles disminuyen con la edad. Se ha confirmado que existe una correlación entre este parámetro y la progresión de la presbiacusia en mamíferos (Lassale et al., 2017). Las mutaciones homocigóticas del gen IGF1 causan hipoacusia en el hombre y el ratón (Cediel, Riquelme, Contreras, Díaz & Varela-Nieto, 2006), mientras que las mutaciones heterocigóticas en el ratón se asocian a presbiacusia y a susceptibilidad al daño por ruido (Celaya et al., 2021; Riquelme et al., 2010). Además, los ratones mutados que no expresan la fosfatasa dual DUSP-1, una diana intracelular del IGF1, reguladora clave del estrés oxidativo y de la respuesta inflamatoria, presentan pérdida auditiva prematura a partir de los 4 meses de edad (Bermúdez-Muñoz et al., 2021; Celaya et al., 2019). De igual manera, la caracterización de ratones mutantes en Mpzl2 o Slc7a8 nos ha permitido confirmar que son genes de susceptibilidad al envejecimiento auditivo también en el ratón y proponer mecanismos moleculares responsables de la predisposición a la presbiacusia que no podrían haberse descrito en los pacientes (Espino-Guarch et al., 2018; Wesdorp et al., 2018).
Los modelos animales también sirven para estudiar el efecto que tienen los factores ambientales en el envejecimiento auditivo. Así, numerosos estudios demuestran que la exposición crónica al ruido de baja intensidad favorece la aparición de la presbiacusia. Curiosamente, algunos genes de susceptibilidad a la presbiacusia están implicados también en una mayor sensibilidad a la hipoacusia inducida por exposición a ruido, como Cdh23 o Igf1 (Celaya et al., 2021; Holme & Steel, 2004). Varios estudios de asociación del genoma completo en diferentes estirpes de ratón han identificado una serie de locus que estarían relacionados con una mayor sensibilidad a la pérdida auditiva por ruido y por envejecimiento (Lavinsky et al., 2016). Otro factor externo estudiado en ratones es la nutrición y su efecto sobre la aparición de presbiacusia. Así, se ha confirmado que ciertos déficits nutricionales, por ejemplo, en ácido fólico y vitaminas del grupo B, pueden agravar el proceso, mientras que la suplementación con ácidos grasos omega 3 pueden mejorar la presbiacusia en estirpes susceptibles como C57 (Martínez-Vega, Garrido, et al., 2015; Martínez-Vega, Partearroyo et al., 2015).
Por último, los ensayos con modelos animales son imprescindibles (y un imperativo legal) para la evaluación de la seguridad y eficacia de nuevos fármacos que prevengan o retrasen el desarrollo de la presbiacusia. En la actualidad están en estudio numerosos fármacos y terapias (nutricional, génica, celular) que podrían prevenir la aparición o ralentizar la progresión de la pérdida auditiva. La producción excesiva de radicales libres y el agotamiento de los sistemas antioxidantes celulares son procesos clave en el desarrollo de la presbiacusia y, por ello, la reducción del estrés oxidativo constituye una estrategia interesante para su prevención o tratamiento (Pak, Kim, Yi & Chung, 2020). Diversas moléculas con efecto antioxidante como la N-acetil cisteína, el resveratrol o el ácido lipoico han sido evaluadas en modelos murinos de presbiacusia con efectos positivos (Huang et al., 2020; Marie et al., 2018; Muderris et al., 2022). En pacientes, la administración de combinaciones de antioxidantes (vitaminas, ácido lipoico), así como también los suplementos nutricionales, han demostrado su eficacia para ralentizar la pérdida auditiva asociada a la edad (Durga, Verhoef, Anteunis, Schouten & Kok, 2007; Polanski & Cruz, 2013; Takumida & Anniko, 2009).
Las terapias génica y celular, en fase experimental, son aproximaciones que pueden contribuir, junto con la farmacológica, a evitar el deterioro de la cóclea con la edad o a sustituir células degeneradas por nuevas células funcionales (Nourbakhsh et al., 2021). Las nuevas herramientas de edición génica han abierto un campo amplio de oportunidades para tratar algunas formas genéticas de sordera congénita que podrían ofrecer también nuevas perspectivas para la presbiacusia en un futuro (Botto, Dalkara & El-Amraoui, 2021).
Conclusiones
La pérdida auditiva asociada a la edad es un problema de primer orden debido al envejecimiento de la población y a su directa asociación con el deterioro cognitivo. Reconocer el problema, desarrollar una política activa para reducir factores de riesgo y ampliar la cobertura sanitaria de la pérdida auditiva contribuiría a aumentar los años de vida activa e independiente. No es menor la importancia de la concienciación de la sociedad para la prevención del problema y su detección temprana. Además, es prioritario invertir en la investigación para el desarrollo de tratamientos que eviten las alteraciones degenerativas en el oído interno.
Los últimos años estamos asistiendo a una revolución en este campo liderada por las nuevas técnicas genéticas, los avances en terapias celulares avanzadas, en electrónica, en secuenciación, las perspectivas que ofrece la inteligencia artificial para el diagnóstico, la evolución de la imagen médica y la microscopia avanzada, y un largo etcétera que ofrecen una combinación esperanzadora para el paciente. En suma, la investigación multidisciplinar en audición está permitiendo avances que en el corto y medio plazo contribuirán a aumentar la batería de pruebas de diagnóstico y las opciones de tratamiento que, combinados con los audífonos y los implantes cocleares, mejorarán la calidad de vida de nuestros mayores y de todos los que padecen hipoacusia.
Referencias
Attias, J., Zarchi, O., Nageris, B. I. & Laron, Z. (2012). Cochlear hearing loss in patients with Laron syndrome. Eur Arch Otorhinolaryngol, 269(2), 461–466. https://doi.org/10.1007/s00405-011-1668-x
Bai, U., Seidman, M. D., Hinojosa, R. & Quirk, W. S. (1997). Mitochondrial DNA deletions associated with aging and possibly presbycusis: A human archival temporal bone study. Am J Otol, 18(4), 449–453.
Bared, A., Ouyang, X., Angeli, S., Du, L. L., Hoang, K., Yan, D. & Liu, X. Z. (2010). Antioxidant enzymes, presbycusis, and ethnic variability. Otolaryngol Head Neck Surg, 143(2), 263–268. https://doi.org/10.1016/j.otohns.2010.03.024
Bermudez-Munoz, J. M., Celaya, A. M., Garcia-Mato, A., Munoz-Espin, D., Rodriguez-de la Rosa, L., Serrano, M. & Varela-Nieto, I. (2021). Dual-Specificity Phosphatase 1 (DUSP1) Has a Central Role in Redox Homeostasis and Inflammation in the Mouse Cochlea. Antioxidants (Basel), 10(9), 1351. https://doi.org/10.3390/antiox10091351
Besser, J., Stropahl, M., Urry, E. & Launer, S. (2018). Comorbidities of hearing loss and the implications of multimorbidity for audiological care. Hear Res, 369, 3–14. https://doi.org/10.1016/j.heares.2018.06.008
Botto, C., Dalkara, D. & El-Amraoui, A. (2021). Progress in Gene Editing Tools and Their Potential for Correcting Mutations Underlying Hearing and Vision Loss. Front Genome Ed, 3, 737632. https://doi.org/10.3389/fgeed.2021.737632
Bowl, M. R. & Dawson, S. J. (2015). The mouse as a model for age-related hearing loss—A mini-review. Gerontology, 61(2), 149–157. https://doi.org/10.1159/000368399
Calvino, M., Sanchez-Cuadrado, I., Gavilan, J., Gutierrez-Revilla, M. A., Polo, R. & Lassaletta, L. (2022). Effect of cochlear implantation on cognitive decline and quality of life in younger and older adults with severe-to-profound hearing loss. Eur Arch Otorhinolaryngol. https://doi.org/10.1007/s00405-022-07253-6
Camarero, G., Villar, M. A., Contreras, J., Fernandez-Moreno, C., Pichel, J. G., Avendano, C. & Varela-Nieto, I. (2002). Cochlear abnormalities in insulin-like growth factor-1 mouse mutants. Hear Res, 170(1–2), 2–11. https://doi.org/10.1016/s0378-5955(02)00447-1
Cediel, R., Riquelme, R., Contreras, J., Diaz, A. & Varela-Nieto, I. (2006). Sensorineural hearing loss in insulin-like growth factor I-null mice: A new model of human deafness. Eur J Neurosci, 23(2), 587–590. https://doi.org/10.1111/j.1460-9568.2005.04584.x
Celaya, A. M., Rodriguez-de la Rosa, L., Bermudez-Munoz, J. M., Zubeldia, J. M., Roma-Mateo, C., Avendano, C., Pallardo, F. V. & Varela-Nieto, I. (2021). IGF-1 Haploinsufficiency Causes Age-Related Chronic Cochlear Inflammation and Increases Noise-Induced Hearing Loss. Cells, 10(7). https://doi.org/10.3390/cells10071686
Celaya, A. M., Sanchez-Perez, I., Bermudez-Munoz, J. M., Rodriguez-de la Rosa, L., Pintado-Berninches, L., Perona, R., Murillo-Cuesta, S. & Varela-Nieto, I. (2019). Deficit of mitogen-activated protein kinase phosphatase 1 (DUSP1) accelerates progressive hearing loss. Elife, 8, 39159. https://doi.org/10.7554/eLife.39159
Di Stazio, M., Morgan, A., Brumat, M., Bassani, S., Dell’Orco, D., Marino, V., Garagnani, P., Giuliani, C., Gasparini, P. & Girotto, G. (2020). New age-related hearing loss candidate genes in humans: An ongoing challenge. Gene, 742, 144561. https://doi.org/10.1016/j.gene.2020.144561
Durga, J., Verhoef, P., Anteunis, L. J., Schouten, E. & Kok, F. J. (2007). Effects of folic acid supplementation on hearing in older adults: A randomized, controlled trial. Ann Intern Med, 146(1), 1–9. https://doi.org/10.7326/0003-4819-146-1-200701020-00003
Espino Guarch, M., Font-Llitjós, M., Murillo-Cuesta, S., Errasti- Murugarren, E., Celaya, A. M., Girotto, G., Vuckovic, D., Mezzavilla, M., Vilches, C., Bodoy, S., Sahún, I., González, L., Prat, E., Zorzano, A., Dierssen, M., Varela-Nieto, I., Gasparini, P., Palacín, M. & Nunes, V. (2018). Mutations in L-type amino acid transporter-2 support SLC7A8 as a novel gene involved in age-related hearing loss. ELife, 7, 31511. https://doi.org/10.7554/eLife.31511.028
Fetoni, A. R., Zorzi, V., Paciello, F., Ziraldo, G., Peres, C., Raspa, M., Scavizzi, F., Salvatore, A. M., Crispino, G., Tognola, G., Gentile, G., Spampinato, A. G., Cuccaro, D., Guarnaccia, M., Morello, G., Van Camp, G., Fransen, E., Brumat, M., Girotto, G., … Mammano, F. (2018). Cx26 partial loss causes accelerated presbycusis by redox imbalance and dysregulation of Nfr2 pathway. Redox Biol, 19, 301–317. https://doi.org/10.1016/j.redox.2018.08.002
Fransen, E., Bonneux, S., Corneveaux, J. J., Schrauwen, I., Di Berardino, F., White, C. H., Ohmen, J. D., Van de Heyning, P., Ambrosetti, U., Huentelman, M. J., Van Camp, G. & Friedman, R. A. (2015). Genome-wide association analysis demonstrates the highly polygenic character of age-related hearing impairment. Eur J Hum Genet, 23(1), 110–115. https://doi.org/10.1038/ejhg.2014.56
Friedman, R. A., Van Laer, L., Huentelman, M. J., Sheth, S. S., Van Eyken, E., Corneveaux, J. J., Tembe, W. D., Halperin, R. F., Thorburn, A. Q., Thys, S., Bonneux, S., Fransen, E., Huyghe, J., Pyykko, I., Cremers, C. W., Kremer, H., Dhooge, I., Stephens, D., Orzan, E., … Van Camp, G. (2009). GRM7 variants confer susceptibility to age-related hearing impairment. Hum Mol Genet, 18(4), 785–796. https://doi.org/10.1093/hmg/ddn402
Girotto, G., Pirastu, N., Sorice, R., Biino, G., Campbell, H., d’Adamo, A. P., Hastie, N. D., Nutile, T., Polasek, O., Portas, L., Rudan, I., Ulivi, S., Zemunik, T., Wright, A. F., Ciullo, M., Hayward, C., Pirastu, M. & Gasparini, P. (2011). Hearing function and thresholds: A genome-wide association study in European isolated populations identifies new loci and pathways. J Med Genet, 48(6), 369–374. https://doi.org/10.1136/jmg.2010.088310
Hoffmann, T. J., Keats, B. J., Yoshikawa, N., Schaefer, C., Risch, N. & Lustig, L. R. (2016). A Large Genome-Wide Association Study of Age-Related Hearing Impairment Using Electronic Health Records. PLoS Genet, 12(10), e1006371 https://doi.org/10.1371/journal.pgen.1006371
Holme, R. H. & Steel, K. P. (2004). Progressive hearing loss and increased susceptibility to noise-induced hearing loss in mice carrying a Cdh23 but not a Myo7a mutation. J Assoc Res Otolaryngol, 5(1), 66–79. https://doi.org/10.1007/s10162-003-4021-2
Huang, S., Xu, A., Sun, X., Shang, W., Zhou, B., Xie, Y., Zhao, M., Li, P., Lu, P., Liu, T. & Han, F. (2020). Otoprotective Effects of alpha-lipoic Acid on A/J Mice With Age-related Hearing Loss. Otol Neurotol, 41(6), e648–e654. https://doi.org/10.1097/MAO.0000000000002643
Ivarsdottir, E. V., Holm, H., Benonisdottir, S., Olafsdottir, T., Sveinbjornsson, G., Thorleifsson, G., Eggertsson, H. P., Halldorsson, G. H., Hjorleifsson, K. E., Melsted, P., Gylfason, A., Arnadottir, G. A., Oddsson, A., Jensson, B. O., Jonasdottir, A., Jonasdottir, A., Juliusdottir, T., Stefansdottir, L., Tragante, V., … Stefansson, K. (2021). The genetic architecture of age-related hearing impairment revealed by genome-wide association analysis. Commun Biol, 4(1), 706. https://doi.org/10.1038/s42003-021-02224-9
Joo, Y., Cruickshanks, K. J., Klein, B. E. K., Klein, R., Hong, O. & Wallhagen, M. I. (2020). The Contribution of Ototoxic Medications to Hearing Loss Among Older Adults. J Gerontol A Biol Sci Med Sci, 75(3), 561–566. https://doi.org/10.1093/gerona/glz166
Kim, S. Y., Lim, J. S., Kong, I. G. & Choi, H. G. (2018). Hearing impairment and the risk of neurodegenerative dementia: A longitudinal follow-up study using a national sample cohort. Sci Rep, 8(1), 15266. https://doi.org/10.1038/s41598-018-33325-x
Kuo, P. L., Moore, A. Z., Lin, F. R. & Ferrucci, L. (2021). Epigenetic Age Acceleration and Hearing: Observations From the Baltimore Longitudinal Study of Aging. Front Aging Neurosci, 13, 790926. https://doi.org/10.3389/fnagi.2021.790926
Kytövuori, L., Hannula, S., Mäki-Torkko, E., Sorri, M. & Majamaa, K. (2017). A nonsynonymous mutation in the WFS1 gene in a Finnish family with age-related hearing impairment. Hearing Research, 355, 97–101. https://doi.org/10.1016/j.heares.2017.09.013
Lassale, C., Batty, G. D., Steptoe, A. & Zaninotto, P. (2017). Insulin-like Growth Factor 1 in relation to future hearing impairment: Findings from the English Longitudinal Study of Ageing. Sci Rep, 7(1), 4212. https://doi.org/10.1038/s41598-017-04526-7
Lavinsky, J., Ge, M., Crow, A. L., Pan, C., Wang, J., Salehi, P., Myint, A., Eskin, E., Allayee, H., Lusis, A. J. & Friedman, R. A. (2016). The Genetic Architecture of Noise-Induced Hearing Loss: Evidence for a Gene-by-Environment Interaction. G3 (Bethesda), 6(10), 3219–3228. https://doi.org/10.1534/g3.116.032516
Liberman, M. C. (2017). Noise-induced and age-related hearing loss: New perspectives and potential therapies. F1000Res, 6, 927. https://doi.org/10.12688/f1000research.11310.1
Lopez-Otin, C., Blasco, M. A., Partridge, L., Serrano, M. & Kroemer, G. (2013). The hallmarks of aging. Cell, 153(6), 1194–1217. https://doi.org/10.1016/j.cell.2013.05.039
Maharani, A., Dawes, P., Nazroo, J., Tampubolon, G., Pendleton, N. & group, S. E.-C. W. (2018). Longitudinal Relationship Between Hearing Aid Use and Cognitive Function in Older Americans. J Am Geriatr Soc, 66(6), 1130–1136. https://doi.org/10.1111/jgs.15363
Manche, S. K., Jangala, M., Dudekula, D., Koralla, M. & Akka, J. (2018). Polymorphisms in folate metabolism genes are associated with susceptibility to presbycusis. Life Sci, 196, 77–83. https://doi.org/10.1016/j.lfs.2018.01.015
Marie, A., Larroze-Chicot, P., Cosnier-Pucheu, S. & Gonzalez-Gonzalez, S. (2017). Senescence-accelerated mouse prone 8 (SAMP8) as a model of age-related hearing loss. Neurosci Lett, 656, 138–143. https://doi.org/10.1016/j.neulet.2017.07.037
Marie, A., Meunier, J., Brun, E., Malmstrom, S., Baudoux, V., Flaszka, E., Naert, G., Roman, F., Cosnier-Pucheu, S. & Gonzalez-Gonzalez, S. (2018). N-acetylcysteine Treatment Reduces Age-related Hearing Loss and Memory Impairment in the Senescence-Accelerated Prone 8 (SAMP8) Mouse Model. Aging Dis, 9(4), 664–673. https://doi.org/10.14336/AD.2017.0930
Martinez-Vega, R., Garrido, F., Partearroyo, T., Cediel, R., Zeisel, S. H., Martinez-Alvarez, C., Varela-Moreiras, G., Varela-Nieto, I. & Pajares, M. A. (2015). Folic acid deficiency induces premature hearing loss through mechanisms involving cochlear oxidative stress and impairment of homocysteine metabolism. FASEB J, 29(2), 418–432. https://doi.org/10.1096/fj.14-259283
Martinez-Vega, R., Partearroyo, T., Vallecillo, N., Varela-Moreiras, G., Pajares, M. A. & Varela-Nieto, I. (2015). Long-term omega-3 fatty acid supplementation prevents expression changes in cochlear homocysteine metabolism and ameliorates progressive hearing loss in C57BL/6J mice. J Nutr Biochem, 26(12), 1424–1433. https://doi.org/10.1016/j.jnutbio.2015.07.011
Momi, S. K., Wolber, L. E., Fabiane, S. M., MacGregor, A. J. & Williams, F. M. (2015). Genetic and Environmental Factors in Age-Related Hearing Impairment. Twin Res Hum Genet, 18(4), 383–392. https://doi.org/10.1017/thg.2015.35
Muderris, T., Yar Saglam, A. S., Unsal, D., Mulazimoglu, S., Sevil, E. & Kayhan, H. (2022). Efficiency of resveratrol in the prevention and treatment of age-related hearing loss. Exp Ther Med, 23(1), 40. https://doi.org/10.3892/etm.2021.10962. PMID: 34849155
Nagtegaal, A. P., Broer, L., Zilhao, N. R., Jakobsdottir, J., Bishop, C. E., Brumat, M., Christiansen, M. W., Cocca, M., Gao, Y., Heard-Costa, N. L., Evans, D. S., Pankratz, N., Pratt, S. R., Price, T. R., Spankovich, C., Stimson, M. R., Valle, K., Vuckovic, D., Wells, H., … Goedegebure, A. (2019). Genome-wide association meta-analysis identifies five novel loci for age-related hearing impairment. Sci Rep, 9(1), 15192. https://doi.org/10.1038/s41598-019-51630-x
Newman, D. L., Fisher, L. M., Ohmen, J., Parody, R., Fong, C. T., Frisina, S. T., Mapes, F., Eddins, D. A., Robert Frisina, D., Frisina, R. D. & Friedman, R. A. (2012). GRM7 variants associated with age-related hearing loss based on auditory perception. Hear Res, 294(1–2), 125–132. https://doi.org/10.1016/j.heares.2012.08.016
Noben-Trauth, K., Zheng, Q. Y. & Johnson, K. R. (2003). Association of cadherin 23 with polygenic inheritance and genetic modification of sensorineural hearing loss. Nat Genet, 35(1), 21–23. https://doi.org/10.1038/ng1226
Nolan, L. S., Cadge, B. A., Gomez-Dorado, M. & Dawson, S. J. (2013). A functional and genetic analysis of SOD2 promoter variants and their contribution to age-related hearing loss. Mech Ageing Dev, 134(7–8), 298–306. https://doi.org/10.1016/j.mad.2013.02.009
Nolan, L. S., Maier, H., Hermans-Borgmeyer, I., Girotto, G., Ecob, R., Pirastu, N., Cadge, B. A., Hubner, C., Gasparini, P., Strachan, D. P., Davis, A. & Dawson, S. J. (2013). Estrogen-related receptor gamma and hearing function: Evidence of a role in humans and mice. Neurobiol Aging, 34(8), 2077 e1-9. https://doi.org/10.1016/j.neurobiolaging.2013.02.009
Nourbakhsh, A., Colbert, B. M., Nisenbaum, E., El-Amraoui, A., Dykxhoorn, D. M., Koehler, K. R., Chen, Z. Y. & Liu, X. Z. (2021). Stem Cells and Gene Therapy in Progressive Hearing Loss: The State of the Art. J Assoc Res Otolaryngol, 22(2), 95–105. https://doi.org/10.1007/s10162-020-00781-0
O’Grady, G., Boyles, A. L., Speer, M., DeRuyter, F., Strittmatter, W. & Worley, G. (2007). Apolipoprotein E alleles and sensorineural hearing loss. Int J Audiol, 46(4), 183–186. https://doi.org/10.1080/14992020601145294
Olusanya, B. O., Davis, A. C. & Hoffman, H. J. (2019). Hearing loss grades and the International classification of functioning, disability and health. Bull World Health Organ, 97(10), 725–728. https://doi.org/10.2471/BLT.19.230367
Pak, J. H., Kim, Y., Yi, J. & Chung, J. W. (2020). Antioxidant Therapy against Oxidative Damage of the Inner Ear: Protection and Preconditioning. Antioxidants (Basel), 9(11), 1076. https://doi.org/10.3390/antiox9111076
Panza, F., Solfrizzi, V. & Logroscino, G. (2015). Age-related hearing impairment-a risk factor and frailty marker for dementia and AD. Nat Rev Neurol, 11(3), 166–175. https://doi.org/10.1038/nrneurol.2015.12
Paplou, V., Schubert, N. M. A. & Pyott, S. J. (2021). Age-Related Changes in the Cochlea and Vestibule: Shared Patterns and Processes. Front Neurosci, 15, 680856. https://doi.org/10.3389/fnins.2021.680856
Partearroyo, T., Vallecillo, N., Pajares, M. A., Varela-Moreiras, G. & Varela-Nieto, I. (2017). Cochlear Homocysteine Metabolism at the Crossroad of Nutrition and Sensorineural Hearing Loss. Front Mol Neurosci, 10, 107. https://doi.org/10.3389/fnmol.2017.00107
Polanski, J. F. & Cruz, O. L. (2013). Evaluation of antioxidant treatment in presbyacusis: Prospective, placebo-controlled, double-blind, randomised trial. J Laryngol Otol, 127(2), 134–141. https://doi.org/10.1017/S0022215112003118
Prado-Barreto, V. M., Salvatori, R., Santos Junior, R. C., Brandao-Martins, M. B., Correa, E. A., Garcez, F. B., Valenca, E. H., Souza, A. H., Pereira, R. M., Nunes, M. A., D’Avila, J. S. & Aguiar-Oliveira, M. H. (2014). Hearing status in adult individuals with lifetime, untreated isolated growth hormone deficiency. Otolaryngol Head Neck Surg, 150(3), 464–471. https://doi.org/10.1177/0194599813517987
Rai, V., Tu, S., Frank, J. R. & Zuo, J. (2021). Molecular Pathways Modulating Sensory Hair Cell Regeneration in Adult Mammalian Cochleae: Progress and Perspectives. Int J Mol Sci, 23(1). https://doi.org/10.3390/ijms23010066
Riquelme, R., Cediel, R., Contreras, J., la Rosa Lourdes, R. D., Murillo-Cuesta, S., Hernandez-Sanchez, C., Zubeldia, J. M., Cerdan, S. & Varela-Nieto, I. (2010). A comparative study of age-related hearing loss in wild type and insulin-like growth factor I deficient mice. Front Neuroanat, 4, 27. https://doi.org/10.3389/fnana.2010.00027
Schuknecht, H. F. & Gacek, M. R. (1993). Cochlear pathology in presbycusis. Ann Otol Rhinol Laryngol, 102(1 Pt 2), 1–16. https://doi.org/10.1177/00034894931020S101
Sugiura S, Uchida Y, Nakashima T, Ando F, Shimokata H. (2010). The association between gene polymorphisms in uncoupling proteins and hearing impairment in Japanese elderly. Acta Otolaryngol., 130(4), 487-492. https://doi.org/10.3109/00016480903283758. PMID: 19895332.
Takumida, M. & Anniko, M. (2009). Radical scavengers for elderly patients with age-related hearing loss. Acta Otolaryngol, 129(1), 36–44. https://doi.org/10.1080/00016480802008215
Uchida Y, Sugiura S, Ueda H, Nakashima T, Ando F, Shimokata H. (2014). The association between hearing impairment and polymorphisms of genes encoding inflammatory mediators in Japanese aged population. Immun Ageing, 11(1), 18. https://doi.org/10.1186/s12979-014-0018-4. PMID: 25469152; PMCID: PMC4252019
Uchida, Y., Sugiura, S., Ando, F., Nakashima, T. & Shimokata, H. (2011). Hearing impairment risk and interaction of folate metabolism related gene polymorphisms in an aging study. BMC Med Genet, 12(1), 35. https://doi.org/10.1186/1471-2350-12-35
Uchida, Y., Sugiura, S., Nakashima, T., Ando, F. & Shimokata, H. (2009). Endothelin-1 gene polymorphism and hearing impairment in elderly Japanese. Laryngoscope, 119(5), 938–943. https://doi.org/10.1002/lary.20181
Unal, M., Tamer, L., Dogruer, Z. N., Yildirim, H., Vayisoglu, Y. & Camdeviren, H. (2005). N-acetyltransferase 2 gene polymorphism and presbycusis. Laryngoscope, 115(12), 2238–2241. https://doi.org/10.1097/01.mlg.0000183694.10583.12
Van Eyken, E., Van Camp, G., Fransen, E., Topsakal, V., Hendrickx, J. J., Demeester, K., Van de Heyning, P., Maki-Torkko, E., Hannula, S., Sorri, M., Jensen, M., Parving, A., Bille, M., Baur, M., Pfister, M., Bonaconsa, A., Mazzoli, M., Orzan, E., Espeso, A., … Van Laer, L. (2007). Contribution of the N-acetyltransferase 2 polymorphism NAT2*6A to age-related hearing impairment. J Med Genet, 44(9), 570–578. https://doi.org/10.1136/jmg.2007.049205
Van Eyken, E., Van Laer, L., Fransen, E., Topsakal, V., Lemkens, N., Laureys, W., Nelissen, N., Vandevelde, A., Wienker, T., Van De Heyning, P. & Van Camp, G. (2006). KCNQ4: A gene for age-related hearing impairment? Hum Mutat, 27(10), 1007–1016. https://doi.org/10.1002/humu.20375
Van Laer, L., Huyghe, J. R., Hannula, S., Van Eyken, E., Stephan, D. A., Maki-Torkko, E., Aikio, P., Fransen, E., Lysholm-Bernacchi, A., Sorri, M., Huentelman, M. J. & Van Camp, G. (2010). A genome-wide association study for age-related hearing impairment in the Saami. Eur J Hum Genet, 18(6), 685–693. https://doi.org/10.1038/ejhg.2009.234
Van Laer, L., Van Eyken, E., Fransen, E., Huyghe, J. R., Topsakal, V., Hendrickx, J. J., Hannula, S., Maki-Torkko, E., Jensen, M., Demeester, K., Baur, M., Bonaconsa, A., Mazzoli, M., Espeso, A., Verbruggen, K., Huyghe, J., Huygen, P., Kunst, S., Manninen, M., … Van Camp, G. (2008). The grainyhead like 2 gene (GRHL2), alias TFCP2L3, is associated with age-related hearing impairment. Hum Mol Genet, 17(2), 159–169. https://doi.org/10.1093/hmg/ddm292
Vuckovic, D., Dawson, S., Scheffer, D. I., Rantanen, T., Morgan, A., Di Stazio, M., Vozzi, D., Nutile, T., Concas, M. P., Biino, G., Nolan, L., Bahl, A., Loukola, A., Viljanen, A., Davis, A., Ciullo, M., Corey, D. P., Pirastu, M., Gasparini, P. & Girotto, G. (2015). Genome-wide association analysis on normal hearing function identifies PCDH20 and SLC28A3 as candidates for hearing function and loss. Hum Mol Genet, 24(19), 5655–5664. https://doi.org/10.1093/hmg/ddv279
Wang, J. & Puel, J. L. (2020). Presbycusis: An Update on Cochlear Mechanisms and Therapies. J Clin Med, 9(1), 218. https://doi.org/10.3390/jcm9010218
Wesdorp, M., Murillo-Cuesta, S., Peters, T., Celaya, A. M., Oonk, A., Schraders, M., Oostrik, J., Gomez-Rosas, E., Beynon, A. J., Hartel, B. P., Okkersen, K., Koenen, H., Weeda, J., Lelieveld, S., Voermans, N. C., Joosten, I., Hoyng, C. B., Lichtner, P., Kunst, H. P. M., … Kremer, H. (2018). MPZL2, Encoding the Epithelial Junctional Protein Myelin Protein Zero-like 2, Is Essential for Hearing in Man and Mouse. Am J Hum Genet, 103(1), 74–88. https://doi.org/10.1016/j.ajhg.2018.05.011
Wolber, L. E., Girotto, G., Buniello, A., Vuckovic, D., Pirastu, N., Lorente-Canovas, B., Rudan, I., Hayward, C., Polasek, O., Ciullo, M., Mangino, M., Steves, C., Concas, M. P., Cocca, M., Spector, T. D., Gasparini, P., Steel, K. P. & Williams, F. M. (2014). Salt-inducible kinase 3, SIK3, is a new gene associated with hearing. Hum Mol Genet, 23(23), 6407–6418. https://doi.org/10.1093/hmg/ddu346
World Health Organization. (2021). World Hearing Report (No. 9789240020481). https://www.who.int/publications/i/item/world-report-on-hearing
Conflicto de intereses
Los autores manifiestan no tener ningún tipo de conflicto de interés.
Contribuciones de los autores
BC, JMB y SM: redacción y edición del original; CRG, LL y JC: revisión del original; IVN: obtención de la financiación, revisión y supervisión.
Financiación
Este trabajo ha sido cubierto con los fondos FEDER/CM B2017/BMD-3688-Multitarget&View and EU H2020-INTERREG, 0551_PSL_6_E-NITROPROHEAR en el caso de I.V.-N; FEDER/MICIN, PID2020-115274RB-I00-THEARPY en el caso de I.V.-N. and S.M.C; y ACCI-CIBER-ISCIII ERP1PDI761 en el caso de S.M.C. S.M.C. tiene contrato de investigación con CIBER ISCIII.
Cómo citar:
Cervantes, B., Bermúdez-Muñoz, J.M., Ruiz-García, C., Lassaletta, L., Contreras, J., Murillo-Cuesta, S., and Varela-Nieto, I. (2022).
Bases genéticas, moleculares y bioquímicas del envejecimiento auditivo. ¿Qué nos enseñan los modelos experimentales? Auditio, 6, e84.
https://doi.org/10.51445/sja.auditio.vol6.2022.0084
Correspondencia
*Silvia Murillo-Cuesta
Instituto de Investigaciones
Biomédicas Alberto Sols CSIC-UAM
Arturo Duperier 4, 28029 Madrid, España
Email: smurillo@iib.uam.es
Oficina Editorial
Corrección: Tomás Pérez Pazos.
Traducción: Emma Goldsmith.
Producción: Publicaciones Académicas