Artículos de Investigación
Bases moleculares de la sordera: envejecimiento y nuevas fronteras en la investigación auditiva
Blanca Cervantes1, Pilar López Larrubia2,3  , Isabel Varela-Nieto2,3,4
, Isabel Varela-Nieto2,3,4  , Silvia Murillo-Cuesta2,3,4,*
, Silvia Murillo-Cuesta2,3,4,* 
1 Escuela de Medicina, Universidad Anáhuac Puebla, México / 2Instituto de Investigaciones Biomédicas Sols-Morreale (CSIC-UAM), Madrid, España / 3Centro de Investigación Biomédica en Red en Enfermedades Raras (CIBERER), Madrid, España / 4Instituto de Investigación Sanitaria del Hospital La Paz (IdiPAZ), Madrid, España.
 OPEN ACCESS
OPEN ACCESS
PEER REVIEWED
ARTÍCULO ORIGINAL
DOI: 10.51445/sja.auditio.vol9.2025.123
Recibido: 07.07.2025
Revisado: 02.09.2025
Aceptado: 21.11.2025
Publicado: 30.12.2025
Editado por:
Helia Relaño-Iborra
Eriksholm Research Centre, Dinamarca y Universidad de Rochester, EE.UU.
Revisado por:
Enrique Saldaña Fernández
Universidad de Salamanca. España.
Sara Reda del Barrio
Hospital Universitario 12 de Octubre, Madrid. España.
Teresa Rivera-Rodríguez
Hospital Universitario Príncipe de Asturias, Madrid. España.
Cómo citar:
Cervantes, B.; López Larrubia, P.; Varela-Nieto, I. y Murillo-Cuesta, S. (2025). Bases moleculares de la sordera: envejecimiento y nuevas fronteras en la investigación auditiva. Auditio, 9, e123. https://doi.org/10.51445/sja.auditio.vol9.2025.123
Correspondencia
*Silvia Murillo Cuesta
Arturo Duperier 4. 28029 Madrid, España.
Email: smurillo@iib.uam.es
 CC-BY 4.0
CC-BY 4.0
© 2025 Los autores / The authors
https://journal.auditio.com/
Publicación de la Asociacion Española de Audiología (AEDA)
Resumen
La pérdida auditiva asociada a la edad, conocida como presbiacusia, constituye una de las causas más frecuentes de discapacidad sensorial a nivel mundial. Su origen es multifactorial, determinado por factores genéticos, ambientales, fisiológicos y relacionados con el estilo de vida. Su impacto en el deterioro cognitivo y en la aparición de enfermedades neurodegenerativas ha impulsado un renovado interés por comprender sus bases moleculares, epigenéticas y genéticas.
En esta revisión abordamos los principales mecanismos implicados en la degeneración auditiva vinculada al envejecimiento, identificados tanto en modelos experimentales como en estudios epidemiológicos. Nos centraremos en la respuesta al daño celular como desencadenante de estrés oxidativo, en la neuroinflamación y en las mutaciones genéticas que aumentan la susceptibilidad a la presbiacusia. Asimismo, se analizan las técnicas de diagnóstico por imagen y las perspectivas terapéuticas emergentes que podrían transformar el abordaje clínico de la sordera en un futuro próximo.
Palabras clave
Presbiacusia, respuesta inflamatoria, equilibrio redox, exposoma.
Implicaciones clínicas
La pérdida auditiva asociada al envejecimiento, también conocida como presbiacusia, afecta aproximadamente a un tercio de la población mayor de 65 años y, a partir de los 80, su prevalencia alcanza prácticamente el 100 %. Dado el progresivo envejecimiento poblacional y la estrecha relación entre la pérdida auditiva, el deterioro cognitivo y las enfermedades neurodegenerativas en edades avanzadas, resulta prioritario profundizar en los mecanismos comunes a nivel molecular y celular. Asimismo, es fundamental impulsar el desarrollo de técnicas de imagen y biomarcadores para el diagnóstico temprano, junto con nuevas estrategias terapéuticas orientadas a prevenir, retrasar o incluso evitar la aparición de estas patologías.
Introducción
La audición es un proceso sensorial complejo que depende de la integridad estructural y funcional del sistema auditivo, desde el oído interno hasta las vías auditivas centrales. La pérdida auditiva relacionada con la edad afecta a más del 30 % de las personas mayores de 65 años y se espera que su prevalencia aumente significativamente en las próximas décadas debido al envejecimiento poblacional (Chadha et al., 2021) (Figura 1). La presbiacusia no solo compromete la comunicación y la calidad de vida, sino que también se asocia con el deterioro cognitivo, el aislamiento social y la depresión. Así, un estudio llevado a cabo por The Lancet Commission on Dementia Prevention, Intervention, and Care en 2020 determinó que la pérdida de audición en adultos duplica el riesgo de desarrollar demencia en edades más tardías, lo que la convierte en el principal factor de riesgo potencialmente modificable (Livingston et al., 2020). Además, se estimó que el 8 % de los casos de demencia podrían prevenirse con un diagnóstico temprano y un tratamiento adecuado de la hipoacusia asociada al envejecimiento, por ejemplo, con audífonos. En este sentido, campañas de concienciación y prevención como las desarrolladas por la Organización Mundial de la Salud anualmente en el Día Mundial de la Audición, son esenciales (https://www.youtube.com/watch?v=ZyNTItEmVNQ).
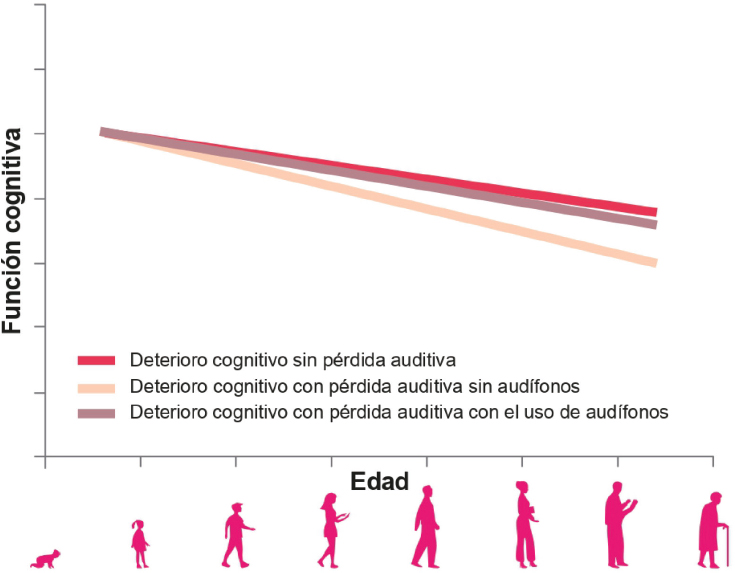
Figura 1. La pérdida auditiva es uno de los factores de riesgo que conducen a la demencia. Durante el envejecimiento se produce una disminución progresiva de la función cognitiva (línea rosa oscuro), pero si el individuo presenta pérdida auditiva, este deterioro cognitivo se agrava y acelera (línea rosa claro). El uso de audífonos reduce este efecto (línea marrón).
Fisiopatología, diagnóstico y tratamiento
Mecanismos moleculares de la presbiacusia
La presbiacusia es el resultado de la degeneración de las estructuras sensoriales y neurales en la cóclea, alteraciones metabólicas, daños mecánicos o una combinación de las anteriores, dando lugar a una pérdida gradual de la sensibilidad auditiva (Gates & Mills, 2005; Keithley, 2020). Histológicamente, los cambios más frecuentemente observados en la cóclea envejecida incluyen degeneración de la estría vascular y pérdida de células ciliadas y de neuronas aferentes primarias, dando lugar a una elevación permanente de los umbrales auditivos (Fetoni et al., 2011). Algunas personas pueden presentar una sensibilidad auditiva normal, pero tienen importantes dificultades de percepción, especialmente la comprensión del habla en entornos ruidosos. Esta afección, denominada pérdida auditiva oculta, se produce, entre otras razones, por la degeneración de las terminales nerviosas aferentes y la pérdida permanente de las conexiones sinápticas entre las células ciliadas internas y las neuronas del nervio auditivo, conocida como sinaptopatía coclear (Kohrman et al., 2020).
Al igual que otras enfermedades multifactoriales, la presbiacusia presenta una gran variación individual en cuanto a su edad de aparición, progresión y magnitud de la degeneración. Esto se debe a que está influida, en gran medida, por la suma de todas las exposiciones al conjunto de factores ambientales, exógenos y endógenos -lo que se conoce como el exposoma-, y por la respuesta a estos a lo largo de la vida del individuo (Cruickshanks et al., 2010; Fetoni et al., 2011).
Al nivel molecular, se han identificado diversos mecanismos patogénicos que contribuyen al desarrollo de la presbiacusia, muchos de ellos comunes a otras enfermedades asociadas al envejecimiento, tales como las alteraciones genéticas y epigenéticas, disfunción mitocondrial, pérdida de la proteostasis, cambios en la autofagia, senescencia celular, alteración de la comunicación intercelular o inflamación crónica, entre otros (Figura 2). Dos de estos procesos, el estrés oxidativo y la inflamación crónica, son los más relevantes en el oído interno, y se discuten a continuación. Este conocimiento se ha alcanzado gracias a la aproximación multidisciplinar de expertos en audición, investigadores clínicos y básicos, y utilizando una combinación de metodologías y de modelos experimentales.
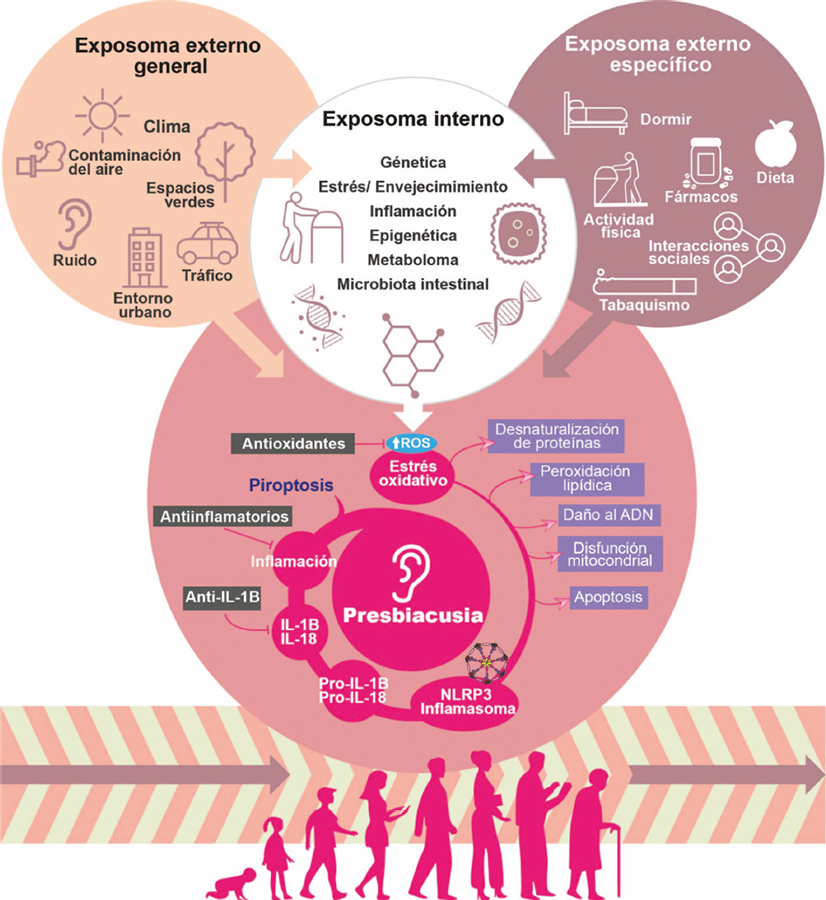
Figura 2. El exposoma externo, tanto general (p.e. el clima) como particular de cada individuo (p.e. dieta), sumado a factores internos (p.e. la composición genética individual), puede modificar la aparición o progresión de la presbiacusia. Se han descrito diversos mecanismos patogénicos implicados en el desarrollo de la presbiacusia, destacando el estrés oxidativo, producido por la acumulación de especies reactivas de oxígeno (ROS), y la inflamación, mediada frecuentemente por la activación del inflamasoma NLRP3 y la subsiguiente producción de citoquinas proinflamatorias como IL-1 beta o IL-18.
Estrés oxidativo
El estrés oxidativo es un sello distintivo del envejecimiento y, por tanto, de las afecciones relacionadas con la edad, como las enfermedades neurodegenerativas y la presbiacusia (López-Otín et al., 2023; Wilson et al., 2023). Se define como un desequilibrio entre la formación y eliminación de especies reactivas de oxígeno (ROS), unas moléculas altamente reactivas producidas durante la respiración mitocondrial y que desempeñan funciones fisiológicas, por ejemplo, participando en la señalización celular cuando se mantienen en niveles bajos o moderados. Las principales ROS incluyen el anión superóxido, el peróxido de hidrógeno, el radical hidroxilo y el óxido nítrico.
Diversos factores exógenos tales como las radiaciones ionizantes, los contaminantes ambientales o algunos fármacos, pueden aumentar la generación de ROS (Pizzino et al., 2017), lo que activa los mecanismos antioxidantes de respuesta de la célula, entre los que destacan el glutatión y las enzimas relacionadas con su producción, la superóxido dismutasa, la catalasa y la metionina sulfóxido reductasa (Paplou et al., 2021). Cuando el nivel de ROS supera la capacidad antioxidante de las células, estas se acumulan, dando lugar a una situación de estrés oxidativo.
El estrés oxidativo es uno de los mecanismos más ampliamente estudiados en la degeneración coclear (Bermúdez-Muñoz et al., 2020; Martínez-Vega, Garrido, et al., 2015). Las células ciliadas del oído interno, responsables de la transducción del sonido, son particularmente vulnerables debido a su alta actividad metabólica. La acumulación de ROS puede dañar lípidos, proteínas y el ADN (Paplou et al., 2021; Someya & Prolla, 2010; Yang et al., 2023). En particular, el ADN mitocondrial (ADNm) es muy susceptible al daño inducido por ROS, debido a que carece de histonas protectoras y se encuentra cerca de los sitios de generación de ROS. La acumulación de ROS en las mitocondrias de las células cocleares puede inducir mutaciones en el ADNm (Wang & Puel, 2020) y, en consecuencia, alterar la función de los complejos proteicos de la cadena respiratoria, lo que conduce a la disfunción mitocondrial y al aumento de la generación de ROS (Teraoka et al., 2024). La desregulación mitocondrial conduce a alteraciones de la homeostasis de calcio, al incremento del calcio intracelular y a la liberación del citocromo c, iniciando la apoptosis (Brookes et al., 2004).
Numerosos estudios en modelos animales indican que el fortalecimiento de los mecanismos de defensa redox puede contribuir a la protección del oído frente a la presbiacusia. Así, el tratamiento con fármacos antioxidantes como la N-Acetilcisteína (NAC) ha demostrado ser una estrategia viable para prevenir o retrasar la presbiacusia en modelos animales, aunque la evidencia en ensayos clínicos es más limitada (Benkafadar et al., 2019). En esta línea, el incremento en los niveles de la glucosa-6-fosfato deshidrogenasa humana (hG6PD) en ratón protege frente al daño oxidativo y ralentiza la progresión de la presbiacusia (Bermúdez-Muñoz et al., 2020). Por otra parte, la deficiencia de la enzima BHMT, que regula los niveles de homocisteína en la cóclea, acelera la presbiacusia y aumenta el daño causado por la exposición a ruido, vinculando el metabolismo de la metionina con la salud auditiva. Estos estudios plantean el potencial interés de intervenciones nutricionales en la prevención de la presbiacusia, por ejemplo, mediante la suplementación de la dieta con ácido fólico o ácidos grasos omega 3 (Martínez-Vega, Garrido, et al., 2015; Martínez-Vega, Partearroyo, et al., 2015; Partearroyo et al., 2019).
Inflamación crónica
Aunque el oído interno se ha considerado tradicionalmente un órgano inmunoprivilegiado, hoy sabemos que las células del sistema inmunitario tienen un papel relevante en la fisiopatología auditiva, y que su activación puede ser tanto protectora como perjudicial, dependiendo del contexto y la duración de la respuesta inflamatoria (Perin et al., 2021).
Durante el envejecimiento, se produce una inflamación crónica tanto en la vía auditiva periférica como en la central (Noble et al., 2022; Parekh & Kaur, 2023; Seicol et al., 2022), que refleja el deterioro general del sistema inmunológico. La activación crónica de las células inmunitarias en el oído interno (macrófagos residentes y células microgliales) genera un entorno proinflamatorio que agrava el daño tisular. Se ha observado un aumento en la expresión de citoquinas como TNF e IL-1beta en modelos animales de presbiacusia (Uraguchi et al., 2021), lo que sugiere que la inflamación crónica tiene un papel clave en la progresión de la pérdida auditiva. El estrés oxidativo puede inducir la respuesta inflamatoria, dado que los niveles elevados de ROS producen la activación del complejo inflamasoma NLRP3 en los macrófagos cocleares (Gregory et al., 2023; Martinon, 2010; Shi et al., 2017), potenciando el proceso de degeneración de las células ciliadas en la presbiacusia (Menardo et al., 2012). El inflamasoma NLRP3 es un complejo molecular citosólico que, una vez ensamblado, adquiere capacidad enzimática mediada por caspasa-1. Esta enzima procesa las pro-citoquinas inflamatorias IL-1beta e IL-18, y la gasdermina D, la cual produce poros en la membrana celular, conduciendo a la liberación de las citoquinas y a la muerte celular por piroptosis (Gregory et al., 2023). Debido al papel que desempeña el inflamasoma en numerosos procesos patológicos, existe un considerable interés en el desarrollo de inhibidores de NLRP3 (El-Sharkawy et al., 2020).
Factores genéticos implicados en presbiacusia
La presbiacusia tiene un componente genético, con una heredabilidad estimada de entre el 35 y el 55 %, según los estudios. Diversos autores han relacionado mutaciones en genes que codifican proteínas esenciales para la función coclear, como GJB2, MYO7A y TMC1, con el desarrollo de la presbiacusia. Estas mutaciones dan lugar a alteraciones en estructuras críticas para el oído como las uniones comunicantes (gap junctions), los estereocilios o los canales iónicos, favoreciendo el deterioro del oído y haciéndolo más susceptible al daño por ruido o fármacos ototóxicos (Shearer et al., 1993). También se han identificado variantes en genes relacionados con la respuesta al estrés oxidativo como SOD, la respuesta inflamatoria, y la función mitocondrial (Ciorba et al., 2015).
Otros genes de potencial predisposición a la presbiacusia humana se han identificado en modelos experimentales de ratón. Así, estudios realizados con ratones Igf1-/- muestran que la deficiencia total del factor de crecimiento similar a la insulina (IGF-1) da lugar a una pérdida auditiva neurosensorial congénita y grave irreversible, mientras que la deficiencia parcial en los ratones Igf1+/- produce una presbiacusia temprana y una mayor susceptibilidad al ruido (Celaya et al., 2021; Riquelme et al., 2010). Cabe destacar que la ausencia en el ratón de una diana de IGF, la fosfatasa dual de MAP quinasas MKP1, adelanta la edad de aparición de la presbiacusia debido a la alteración del equilibrio oxidativo y a un estado de inflamación crónica (Bermúdez-Muñoz et al., 2021; Celaya et al., 2019). Este hallazgo sugiere que la modulación de vías de señalización intracelular podría abrir nuevas estrategias terapéuticas.
La identificación de variantes genéticas asociadas a presbiacusia se ha incrementado en los últimos años gracias a la combinación de estudios de asociación de genoma completo (GWAS) en humanos y de validación de genes en ensayos con animales. Así, se han identificado mutaciones en el gen que codifica para el transportador de aminoácidos SLC7A8 que producen pérdida de función del mismo y que podrían estar relacionadas con el desarrollo de presbiacusia, tanto en humanos como en ratones (Espino Guarch et al., 2018). Este estudio sugiere que este tipo de transportadores podrían ser el origen de algunos trastornos auditivos no caracterizados.
Otros estudios han contribuido a sugerir mecanismos moleculares que podrían modular la progresión de la presbiacusia. Así, utilizando ratones albinos Tyr-/- (con mutaciones en el gen de la tirosinasa), pigmentados YRT2 (transgénicos que expresan el gen de la tirosinasa, un gen que restaura la producción de melanina en sus melanocitos) y albinos TyrTH (ratones que expresan tirosina hidroxilasa pero no tirosinasa) se ha observado que los precursores de melanina, como la L-DOPA, previenen la presbiacusia prematura y la pérdida auditiva inducida por ruido, característica de los ratones albinos (Murillo-Cuesta et al., 2010). Como se ha comentado previamente, las mutaciones en genes implicados en el complejo metabolismo de la metionina en la cóclea (por ejemplo, Bhmt) pueden dar lugar a un aumento de los niveles de homocisteína y a una reducción de la producción de glutatión, principal antioxidante celular (Partearroyo et al., 2019). Los defectos auditivos observados en el ratón Bhmt-/- son similares a los que se observan en ratones silvestres tras una dieta deficiente en ácido fólico, e incluyen un deterioro del metabolismo de la homocisteína coclear y un grave desequilibrio oxidativo con aumento en la expresión de citoquinas proinflamatorias, que en conjunto conducen a la pérdida auditiva prematura (Martínez-Vega, Garrido, et al., 2015). Estas alteraciones pueden revertirse parcialmente mediante suplementación con ácidos grasos omega-3 (Martínez-Vega, Partearroyo, et al., 2015), lo que sugiere que la intervención nutricional dirigida a preservar el metabolismo de la homocisteína podría prevenir la pérdida auditiva en el envejecimiento. La validación en modelos animales de variantes genéticas encontradas en estudios genómicos en humanos ha permitido la incorporación de estos genes en paneles diagnósticos.
Combinaciones de factores ambientales y epigenéticos
Además de la nutrición, otros factores ambientales, como la exposición al ruido o el uso de ciertos medicamentos a lo largo de la vida, pueden contribuir a modificar la aparición y el desarrollo de la presbiacusia. Así, un estudio retrospectivo reveló que los trabajadores con exposición crónica al ruido ocupacional tienen una mayor probabilidad de desarrollar pérdida auditiva con la edad (Jafari et al., 2020). De igual forma, un análisis de datos procedentes del Biobanco del Reino Unido, incluyendo adultos de 40 a 69 años, mostró que el tabaquismo tanto activo como pasivo contribuye al desarrollo de la pérdida auditiva (Dawes et al., 2014). Estos estudios sugieren que los factores del estilo de vida pueden acelerar la pérdida auditiva asociada al envejecimiento.
Se ha propuesto que estos factores ambientales actuarían a través de mecanismos epigenéticos, como la metilación del ADN, las modificaciones de las histonas y los ARN no codificantes, que regulan la expresión génica sin alterar las secuencias de nucleótidos. La epigenética parece desempeñar un papel crucial en la pérdida auditiva neurosensorial e intervenciones a este nivel podrían revertir cambios patológicos asociados a la edad y restaurar la función coclear. Así, estudios recientes que comparan los patrones de metilación del ADN de sujetos control y pacientes con presbiacusia describen la fuerte correlación existente entre la pérdida auditiva prematura y la metilación de sitios específicos en genes candidatos de presbiacusia como KCNQ1, TMEM43, GSR (Roche et al., 2025) o CDH23 (Bouzid et al., 2018). Estudios con gemelos también han confirmado que la capacidad auditiva está fuertemente asociada a los niveles de metilación del ADN. Sin embargo, el potencial uso de los niveles de metilación como biomarcador de este proceso está todavía en estudio.
Diagnóstico mediante imagen médica y nuevas perspectivas terapéuticas en la presbiacusia
Si bien los avances en genética y biología molecular han permitido identificar múltiples mecanismos implicados en la etiología de la presbiacusia, el diagnóstico precoz y la monitorización de su progresión siguen siendo limitados. En este contexto, las técnicas de imagen médica y las estrategias terapéuticas emergentes ofrecen nuevas oportunidades para transformar el abordaje clínico de esta patología.
Imagen médica en el diagnóstico auditivo
Tradicionalmente, el diagnóstico clínico de la pérdida auditiva se ha basado en pruebas funcionales como la audiometría tonal y verbal. Sin embargo, estas herramientas no permiten visualizar directamente los cambios estructurales o bioquímicos en el oído interno. En la última década, la investigación en diagnóstico por imagen de la pérdida auditiva relacionada con la edad ha experimentado avances significativos, incorporando técnicas de alta resolución que permiten visualizar estructuras del oído interno previamente inaccesibles. Las técnicas de imagen moderna no solo facilitan el diagnóstico diferencial, sino que también abren nuevas vías para la medicina personalizada en el tratamiento de la presbiacusia, ya que permiten una comprensión más profunda de los mecanismos subyacentes al deterioro auditivo asociado al envejecimiento.
Entre estas técnicas, que no solo mejoran el diagnóstico diferencial entre distintos tipos de hipoacusia, sino que también permiten evaluar la eficacia de intervenciones terapéuticas en estudios longitudinales, destacan las indicadas en la Tabla 1.
Tabla 1. Técnicas de imagen biomédica empleadas en el estudio de la hipoacusia.
Técnica |
Aplicación |
Referencias |
Imagen por resonancia magnética (MRI) |
Permite visualizar con gran detalle estructuras del oído interno, el nervio auditivo y el tronco encefálico. Posibilita, además, analizar la actividad cerebral en respuesta a estímulos auditivos y evaluar la integridad de las fibras nerviosas en el sistema auditivo y posibles alteraciones en la conectividad neuronal. |
(Chen et al., 2018; Conte et al., 2017; Ratnanather, 2020; Todic et al., 2022) |
Tomografía computarizada (TC) |
Útil para evaluar alteraciones óseas en la cápsula ótica y la integridad de las espiras cocleares, aunque con menor resolución de tejidos blandos. |
(Buschle et al., 2024; Salata et al., 2019; Wegner et al., 2016) |
Tomografía por emisión de positrones (PET) |
Permite estudiar la actividad metabólica y la neuroinflamación mediante trazadores específicos, como aquellos dirigidos a receptores de citoquinas o a células inmunitarias activadas. Ofrece información única sobre los cambios metabólicos cerebrales secundarios a la deprivación auditiva. |
(Sakurai et al., 2025; Speck et al., 2020; Verger et al., 2017) |
La MRI puede contribuir al estudio de la sordera y los problemas asociados desde diferentes abordajes clínicos y preclínicos. La MRI estructural de alta resolución permite observar en detalle estructuras del oído interno y del sistema nervioso central que están implicadas en la audición. La imagen por tensor de difusión (DTI), técnica de MRI que se basa en la difusión del agua en los tejidos biológicos, permite la visualización no invasiva de los fascículos de sustancia blanca en las vías auditivas centrales. En el contexto del envejecimiento auditivo, la DTI puede revelar alteraciones en las vías auditivas centrales que contribuyen a la pérdida auditiva relacionada con la edad, complementando la información estructural obtenida del oído interno. Por último, la resonancia magnética funcional (fMRI) es una herramienta fundamental para estudiar la plasticidad cerebral en respuesta a la pérdida auditiva, especialmente en el contexto del envejecimiento. Su principal contribución radica en la capacidad de visualizar y cuantificar los cambios en la activación y organización funcional de las redes cerebrales tras la deprivación sensorial auditiva. Aunque la fMRI no detecta directamente moléculas, sí permite identificar correlatos funcionales de los procesos moleculares y celulares que subyacen a la sordera.
El desarrollo de sondas multifuncionales dirigidas a biomarcadores específicos del oído interno representa una innovación clave en la imagen biomédica. Estas sondas pueden combinar capacidades diagnósticas y terapéuticas (teragnósticas), permitiendo la detección precoz de daño y la liberación localizada de fármacos. Por ejemplo, se han diseñado nanopartículas que reconocen moléculas asociadas al estrés oxidativo o la apoptosis, como el citocromo c o la caspasa-3, y que liberan antioxidantes o inhibidores de la apoptosis en respuesta a estos estímulos.
Se están desarrollando también biosensores y sondas fluorescentes capaces de detectar biomarcadores de daño coclear, como la generación de ROS y peroxinitrito (ONOO−), que están implicados en la fisiopatología de la sordera relacionada con el envejecimiento (Han et al., 2025). Estas sondas permiten la monitorización en tiempo real de procesos moleculares en células del oído interno y han demostrado alta sensibilidad y especificidad en modelos experimentales (Yan et al., 2024).
En el ámbito clínico, los biomarcadores como la proteína prestina en suero han sido propuestos como indicadores de daño a las células ciliadas externas en la hipoacusia neurosensorial, abriendo la puerta a pruebas diagnósticas mínimamente invasivas (Asli et al., 2023). Por otro lado, la actividad de proteasas como la MMP-14 (MT1-MMP) se ha identificado como biomarcador de daño neuronal y pronóstico en sordera asociada a schwannomas vestibulares, y se están desarrollando sondas activadas por proteasas para su detección y monitorización (Ren et al., 2020).
La integración de estas tecnologías con sistemas de liberación controlada de fármacos y la posibilidad de combinar diagnóstico y terapia en una sola plataforma teragnóstica representa una frontera prometedora para la medicina personalizada en el tratamiento de la sordera.
Terapias farmacológicas en presbiacusia
El conocimiento creciente sobre los mecanismos genéticos y moleculares implicados en la aparición y progresión de la sordera neurosensorial ha impulsado el desarrollo de numerosas estrategias terapéuticas farmacológicas, génicas o celulares, algunas de las cuales han llegado a ensayos en fase clínica, incluyendo antioxidantes como el tiosulfato sódico, antiinflamatorios tipo glucocorticoide, neurotrofinas como el BDNF, o antiapoptóticos (Tabla Suplementaria 1). Entre los últimos encontramos compuestos como el inhibidor de APAF-1 LPT99, que ha mostrado eficacia en modelos animales de ototoxicidad por cisplatino (Murillo-Cuesta et al., 2021), y que ha llegado a su ensayo clínico (ACTRN12618001461280).
Uno de los grandes retos de la terapia auditiva es desarrollar vías y sistemas de administración que mejoren la biodisponibilidad del fármaco en el oído interno. Así, se están desarrollando nuevas formulaciones que mejoren la biodistribución al oído interno de fármacos antiinflamatorios de uso clínico como la dexametasona. Por ejemplo, nanopartículas lipídicas cargadas con glucocorticoides han demostrado un efecto protector en células auditivas expuestas a cisplatino (Cervantes et al., 2019). De igual manera, la dexametasona vehiculizada en un hidrogel de polietilenglicol y trilisina y administrada por vía transtimpánica ha demostrado ser eficaz en modelos de ototoxicidad por LPS (Murillo-Cuesta et al., 2023) y está siendo evaluada en ensayos clínicos (ACTRN12621000964819) para el tratamiento de la enfermedad de Mènière.
La combinación de antioxidantes, antiinflamatorios o moduladores genéticos podría ofrecer un enfoque sinérgico para frenar la progresión de la presbiacusia. Ensayos preclínicos han mostrado que compuestos como la NAC y el resveratrol reducen el daño inducido por ROS, mientras que inhibidores de citoquinas como TNF-α e IL-1beta podrían mitigar la neuroinflamación (Le Prell et al., 2007).
Terapias avanzadas en presbiacusia
Además de los enfoques farmacológicos, se están explorando otras estrategias terapéuticas con potencial para prevenir o revertir la hipoacusia:
Terapia génica “correctora”. La terapia génica representa una de las fronteras más prometedoras de la investigación auditiva. Ensayos preclínicos han demostrado que es posible la incorporación de genes funcionales mediante vectores virales y ha mostrado resultados alentadores en modelos animales. Por ejemplo, la restauración de la audición en ratones knockout para el gen que codifica la VGLUT3 mediante terapia génica (Akil et al., 2012) sugiere la viabilidad de esta aproximación. De manera similar, la administración del gen de la otoferlina utilizando vectores AAV duales consiguió la restauración parcial de la hipoacusia profunda en ratones deficientes para OTOF (Al-Moyed et al., 2019) y abrió el camino al tratamiento de pacientes DFNB9. Tan sólo cinco años después, se logró restaurar la audición en varios niños con mutaciones en el gen OTOF, permitiéndoles percibir sonidos por primera vez (Lv et al., 2024). En la actualidad, se están llevando a cabo ensayos clínicos en España, China, EE.UU. y Reino Unido para evaluar la seguridad y eficacia de esta terapia génica, y se está explorando su aplicación para otras mutaciones como las del gen GJB2, que codifica la conexina 26.
La tecnología CRISPR/Cas9 tiene el potencial de corregir mutaciones genéticas mediante la reparación homóloga directa (homologous direct repair, HDR) o de interrumpir mutaciones dominantes mediante la unión de extremos no homólogos (non-homologous end joining, NHEJ). La simplicidad del diseño, así como la velocidad de operación y el bajo costo de su uso, hacen que CRISPR/Cas9 y técnicas similares sean más prometedoras que cualquiera de las técnicas de edición genómica utilizadas anteriormente. Así, se ha evaluado su eficacia en hipoacusia a nivel preclínico, por ejemplo, para corregir las mutaciones en el alelo Cdh23ahl en ratones C57BL/6J, asociadas al desarrollo de presbiacusia en esta estirpe. La reparación mediante HDR con CRISPR/Cas9 del alelo mutado consiguió revertir el fenotipo (Mianné et al., 2016). Igualmente, la administración en terapia CRISPR en la cóclea de ratones Bth (Beethoven, con mutación en el gen Tcm1) neonatos redujo significativamente la pérdida auditiva progresiva característica de este modelo (Gao et al., 2018).
La aplicación de la terapia génica para tratar específicamente la presbiacusia se ha investigado de manera incipiente utilizando modelos de ratón. Así, se ha observado que la inhibición de mTORC1 o la deleción de Sirt1 promueven la supervivencia de células ciliadas y neuronas cocleares y retrasan el inicio de la presbiacusia (Fu et al., 2018; Han et al., 2016). Sin embargo, la traslación a la clínica de la terapia génica requiere superar desafíos como la especificidad celular, la inmunogenicidad y la duración del efecto.
Terapia regenerativa. La regeneración de células ciliadas mediante la reprogramación de células de soporte o el uso de células madre es un campo en rápida evolución. La estrategia regenerativa de células ciliadas más utilizada es la conversión a partir de células de soporte aumentando la expresión de ATOH1, un factor de transcripción esencial para su diferenciación (Izumikawa et al., 2005). Numerosos ensayos preclínicos han demostrado que la transferencia de ATOH1 a las células de soporte mediante vectores adenovirales facilita el desarrollo adecuado de las células ciliadas y mejora la audición (Saeed et al., 2025), y en la actualidad constituye una herramienta potencialmente prometedora para el tratamiento de la hipoacusia. Otra posibilidad estudiada ha sido el bloqueo de la actividad de Notch mediante inhibidores de la gamma-secretasa, permitiendo así que las células de soporte se transformen en nuevas células ciliadas. Hasta el momento, dos ensayos clínicos han evaluado esta aproximación, aunque con resultados modestos (Tabla suplementaria 1).
Respecto a la terapia con células madre, los trabajos seminales de Li et al. consiguieron aislar células madre (stem cells) del oído interno de ratones adultos y trasplantarlas a embriones de pollo, induciendo su diferenciación a células ciliadas (Li et al., 2003). Posteriormente, otros ensayos preclínicos han evaluado el trasplante de células progenitoras neurales en roedores con pérdida auditiva, consiguiendo una limitada regeneración celular y recuperación funcional (Ren et al., 2013). A nivel clínico, un ensayo en fase 1 logró una mejora significativa de los umbrales tras la infusión autóloga de sangre de cordón umbilical en niños (Baumgartner et al., 2018). Aunque los resultados de la terapia con células madre son prometedores, es necesario llevar a cabo más ensayos preclínicos y clínicos para evaluar su seguridad, eficacia y potencial de traslación. En el campo concreto de la presbiacusia, además, es crítico desarrollar protocolos de expansión celular para conseguir un aporte de células abundante y constante, preservar la capacidad de diferenciación de las células madre a largo plazo y minimizar un potencial rechazo del injerto por parte del sistema inmunitario.
Conclusión
La presbiacusia representa un desafío creciente en salud pública debido al envejecimiento poblacional. Se trata de una patología compleja que resulta de la interacción entre factores genéticos y ambientales. La comprensión de los mecanismos subyacentes, como el estrés oxidativo, la inflamación crónica y las alteraciones metabólicas, es esencial para el desarrollo de terapias eficaces. Las nuevas fronteras en la investigación auditiva, incluyendo la terapia génica y la medicina regenerativa, ofrecen esperanzas reales para prevenir o revertir la pérdida auditiva en el futuro. La integración de técnicas de imagen avanzada, de biomarcadores moleculares y de terapias personalizadas implica una transformación en el manejo clínico de la presbiacusia. La medicina de precisión, basada en el perfil genético y epigenético del paciente, permitirá seleccionar las intervenciones más adecuadas y monitorizar su eficacia. Para conseguir la traslación de estos avances a la práctica clínica, es imprescindible un enfoque multidisciplinar y la colaboración de la audiología, la otorrinolaringología, la neurociencia, la bioingeniería y la farmacología. La investigación traslacional preclínica es clave para validar estas estrategias y garantizar su seguridad y eficacia en ensayos clínicos.
Referencias
Akil, O., Seal, R. P., Burke, K., Wang, C., Alemi, A., During, M., Edwards, R. H., y Lustig, L. R. (2012). Restoration of hearing in the VGLUT3 knockout mouse using virally mediated gene therapy. Neuron, 75(2), 283-93. https://doi.org/10.1016/j.neuron.2012.05.019
Al-Moyed, H., Cepeda, A. P., Jung, S., Moser, T., Kügler, S., y Reisinger, E. (2019). A dual-AAV approach restores fast exocytosis and partially rescues auditory function in deaf otoferlin knock-out mice. EMBO Molecular Medicine, 11(1), e9396. https://doi.org/10.15252/emmm.201809396
Asli, R. H., Akbarpour, M., Lahiji, M. R., Leyli, E. K., Pastadast, M., Ramezani, H., y Nemati, S. (2023). Evaluation of the relationship between prestin serum biomarker and sensorineural hearing loss: A case-control study. European Archives of Oto-Rhino-Laryngology: Official Journal of the European Federation of Oto-Rhino-Laryngological Societies (EUFOS): Affiliated with the German Society for Oto-Rhino-Laryngology - Head and Neck Surgery, 280(3), 1147–1153. https://doi.org/10.1007/s00405-022-07586-2
Baumgartner, L. S., Moore, E., Shook, D., Messina, S., Day, M. C., Green, J., Nandy, R., Seidman, M., y Baumgartner, J. E. (2018). Safety of Autologous Umbilical Cord Blood Therapy for Acquired Sensorineural Hearing Loss in Children. Journal of Audiology & Otology, 22(4), 209–222. https://doi.org/10.7874/jao.2018.00115
Benkafadar, N., François, F., Affortit, C., Casas, F., Ceccato, J.-C., Menardo, J., Venail, F., Malfroy-Camine, B., Puel, J.-L., y Wang, J. (2019). ROS-Induced Activation of DNA Damage Responses Drives Senescence-Like State in Postmitotic Cochlear Cells: Implication for Hearing Preservation. Molecular Neurobiology, 56(8), 5950–5969. https://doi.org/10.1007/s12035-019-1493-6
Bermúdez-Muñoz, J. M., Celaya, A. M., García-Mato, Á., Muñoz-Espín, D., Rodríguez-de la Rosa, L., Serrano, M., y Varela-Nieto, I. (2021). Dual-Specificity Phosphatase 1 (DUSP1) Has a Central Role in Redox Homeostasis and Inflammation in the Mouse Cochlea. Antioxidants (Basel, Switzerland), 10(9), 1351. https://doi.org/10.3390/antiox10091351
Bermúdez-Muñoz, J. M., Celaya, A. M., Hijazo-Pechero, S., Wang, J., Serrano, M., y Varela-Nieto, I. (2020). G6PD overexpression protects from oxidative stress and age-related hearing loss. Aging Cell, 19(12), e13275. https://doi.org/10.1111/acel.13275
Bouzid, A., Smeti, I., Chakroun, A., Loukil, S., Gibriel, A. A., Grati, M., Ghorbel, A., y Masmoudi, S. (2018). CDH23 Methylation Status and Presbycusis Risk in Elderly Women. Frontiers in Aging Neuroscience, 10, 241. https://doi.org/10.3389/fnagi.2018.00241
Brookes, P. S., Yoon, Y., Robotham, J. L., Anders, M. W., y Sheu, S.-S. (2004). Calcium, ATP, and ROS: A mitochondrial love-hate triangle. American Journal of Physiology. Cell Physiology, 287(4), C817-833. https://doi.org/10.1152/ajpcell.00139.2004
Buschle, M., Hamerschmidt, R., Matias, J. E. F., Zanini, O. P. L., Coelho, L. O. de M., y Polanski, J. F. (2024). The Role of Computed Tomography in the Diagnosis of Congenital Sensorineural Hearing Loss. International Archives of Otorhinolaryngology, 28(3), e387–e393. https://doi.org/10.1055/s-0044-1786827
Celaya, A. M., Rodríguez-de la Rosa, L., Bermúdez-Muñoz, J. M., Zubeldia, J. M., Romá-Mateo, C., Avendaño, C., Pallardó, F. V., y Varela-Nieto, I. (2021). IGF-1 Haploinsufficiency Causes Age-Related Chronic Cochlear Inflammation and Increases Noise-Induced Hearing Loss. Cells, 10(7), 1686. https://doi.org/10.3390/cells10071686
Celaya, A. M., Sánchez-Pérez, I., Bermúdez-Muñoz, J. M., Rodríguez-de la Rosa, L., Pintado-Berninches, L., Perona, R., Murillo-Cuesta, S., y Varela-Nieto, I. (2019). Deficit of mitogen-activated protein kinase phosphatase 1 (DUSP1) accelerates progressive hearing loss. ELife, 8. https://doi.org/10.7554/eLife.39159
Cervantes, B., Arana, L., Murillo-Cuesta, S., Bruno, M., Alkorta, I., y Varela-Nieto, I. (2019). Solid Lipid Nanoparticles Loaded with Glucocorticoids Protect Auditory Cells from Cisplatin-Induced Ototoxicity. Journal of Clinical Medicine, 8(9). https://doi.org/10.3390/jcm8091464
Chadha, S., Kamenov, K., y Cieza, A. (2021). The world report on hearing, 2021. Bulletin of the World Health Organization, 99(4), 242-242A. https://doi.org/10.2471/BLT.21.285643
Chen, Y.-C., Chen, H., Jiang, L., Bo, F., Xu, J.-J., Mao, C.-N., Salvi, R., Yin, X., Lu, G., y Gu, J.-P. (2018). Presbycusis Disrupts Spontaneous Activity Revealed by Resting-State Functional MRI. Frontiers in Behavioral Neuroscience, 12, 44. https://doi.org/10.3389/fnbeh.2018.00044
Ciorba, A., Hatzopoulos, S., Bianchini, C., Aimoni, C., Skarzynski, H., y Skarzynski, P. (2015). Genetics of presbycusis and presbystasis. International Journal of Immunopathology and Pharmacology, 28(1), 29–35. https://doi.org/10.1177/0394632015570819
Conte, G., Di Berardino, F., Sina, C., Zanetti, D., Scola, E., Gavagna, C., Gaini, L., Palumbo, G., Capaccio, P., y Triulzi, F. (2017). MR Imaging in Sudden Sensorineural Hearing Loss. Time to Talk. AJNR. American Journal of Neuroradiology, 38(8), 1475–1479. https://doi.org/10.3174/ajnr.A5230
Cruickshanks, K. J., Nondahl, D. M., Tweed, T. S., Wiley, T. L., Klein, B. E. K., Klein, R., Chappell, R., Dalton, D. S., y Nash, S. D. (2010). Education, occupation, noise exposure history and the 10-yr cumulative incidence of hearing impairment in older adults. Hearing Research, 264(1–2), 3–9. https://doi.org/10.1016/j.heares.2009.10.008
Dawes, P., Cruickshanks, K. J., Moore, D. R., Edmondson-Jones, M., McCormack, A., Fortnum, H., y Munro, K. J. (2014). Cigarette smoking, passive smoking, alcohol consumption, and hearing loss. Journal of the Association for Research in Otolaryngology: JARO, 15(4), 663–674. https://doi.org/10.1007/s10162-014-0461-0
El-Sharkawy, L. Y., Brough, D., y Freeman, S. (2020). Inhibiting the NLRP3 Inflammasome. Molecules (Basel, Switzerland), 25(23), 5533. https://doi.org/10.3390/molecules25235533
Espino Guarch, M., Font-Llitjós, M., Murillo-Cuesta, S., Errasti-Murugarren, E., Celaya, A. M., Girotto, G., Vuckovic, D., Mezzavilla, M., Vilches, C., Bodoy, S., Sahún, I., González, L., Prat, E., Zorzano, A., Dierssen, M., Varela-Nieto, I., Gasparini, P., Palacín, M., y Nunes, V. (2018). Mutations in L-type amino acid transporter-2 support SLC7A8 as a novel gene involved in age-related hearing loss. ELife, 7, e31511. https://doi.org/10.7554/eLife.31511
Fetoni, A. R., Picciotti, P. M., Paludetti, G., y Troiani, D. (2011). Pathogenesis of presbycusis in animal models: A review. Experimental Gerontology, 46(6), 413–425. https://doi.org/10.1016/j.exger.2010.12.003
Fu, X., Sun, X., Zhang, L., Jin, Y., Chai, R., Yang, L., Zhang, A., Liu, X., Bai, X., Li, J., Wang, H., y Gao, J. (2018). Tuberous sclerosis complex-mediated mTORC1 overactivation promotes age-related hearing loss. The Journal of Clinical Investigation, 128(11), 4938–4955. https://doi.org/10.1172/JCI98058
Gao, X., Tao, Y., Lamas, V., Huang, M., Yeh, W.-H., Pan, B., Hu, Y.-J., Hu, J. H., Thompson, D. B., Shu, Y., Li, Y., Wang, H., Yang, S., Xu, Q., Polley, D. B., Liberman, M. C., Kong, W.-J., Holt, J. R., Chen, Z.-Y., y Liu, D. R. (2018). Treatment of autosomal dominant hearing loss by in vivo delivery of genome editing agents. Nature, 553(7687), 217–221. https://doi.org/10.1038/nature25164
Gates, G. A., y Mills, J. H. (2005). Presbycusis. Lancet (London, England), 366(9491), 1111–1120. https://doi.org/10.1016/S0140-6736(05)67423-5
Gregory, G. E., Munro, K. J., Couper, K. N., Pathmanaban, O. N., y Brough, D. (2023). The NLRP3 inflammasome as a target for sensorineural hearing loss. Clinical Immunology (Orlando, Fla.), 249, 109287. https://doi.org/10.1016/j.clim.2023.109287
Han, C., Linser, P., Park, H.-J., Kim, M.-J., White, K., Vann, J. M., Ding, D., Prolla, T. A., y Someya, S. (2016). Sirt1 deficiency protects cochlear cells and delays the early onset of age-related hearing loss in C57BL/6 mice. Neurobiology of Aging, 43, 58–71. https://doi.org/10.1016/j.neurobiolaging.2016.03.023
Han, H. H., Ge, P.-X., Li, W.-J., Hu, X.-L., y He, X.-P. (2025). Recent Advancement in Fluorescent Probes for Peroxynitrite (ONOO-). Sensors (Basel, Switzerland), 25(10), 3018. https://doi.org/10.3390/s25103018
Izumikawa, M., Minoda, R., Kawamoto, K., Abrashkin, K. A., Swiderski, D. L., Dolan, D. F., Brough, D. E., y Raphael, Y. (2005). Auditory hair cell replacement and hearing improvement by Atoh1 gene therapy in deaf mammals. Nature Medicine, 11(3), 271–276. https://doi.org/10.1038/nm1193
Jafari, Z., Copps, T., Hole, G., Kolb, B. E., y Mohajerani, M. H. (2020). Noise Damage Accelerates Auditory Aging and Tinnitus: A Canadian Population-Based Study. Otology & Neurotology: Official Publication of the American Otological Society, American Neurotology Society [and] European Academy of Otology and Neurotology, 41(10), 1316–1326. https://doi.org/10.1097/MAO.0000000000002848
Keithley, E. M. (2020). Pathology and mechanisms of cochlear aging. Journal of Neuroscience Research, 98(9), 1674–1684. https://doi.org/10.1002/jnr.24439
Kohrman, D. C., Wan, G., Cassinotti, L., y Corfas, G. (2020). Hidden Hearing Loss: A Disorder with Multiple Etiologies and Mechanisms. Cold Spring Harbor Perspectives in Medicine, 10(1), a035493. https://doi.org/10.1101/cshperspect.a035493
Le Prell, C. G., Yamashita, D., Minami, S. B., Yamasoba, T., y Miller, J. M. (2007). Mechanisms of noise-induced hearing loss indicate multiple methods of prevention. Hearing Research, 226(1–2), 22–43. https://doi.org/10.1016/j.heares.2006.10.006
Li, H., Liu, H., y Heller, S. (2003). Pluripotent stem cells from the adult mouse inner ear. Nature Medicine, 9(10), 1293–1299. https://doi.org/10.1038/nm925
Livingston, G., Huntley, J., Sommerlad, A., Ames, D., Ballard, C., Banerjee, S., Brayne, C., Burns, A., Cohen-Mansfield, J., Cooper, C., Costafreda, S. G., Dias, A., Fox, N., Gitlin, L. N., Howard, R., Kales, H. C., Kivimäki, M., Larson, E. B., Ogunniyi, A., … Mukadam, N. (2020). Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet (London, England), 396(10248), 413–446. https://doi.org/10.1016/S0140-6736(20)30367-6
López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., y Kroemer, G. (2023). Hallmarks of aging: An expanding universe. Cell, 186(2), 243–278. https://doi.org/10.1016/j.cell.2022.11.001
Lv, J., Wang, H., Cheng, X., Chen, Y., Wang, D., Zhang, L., Cao, Q., Tang, H., Hu, S., Gao, K., Xun, M., Wang, J., Wang, Z., Zhu, B., Cui, C., Gao, Z., Guo, L., Yu, S., Jiang, L., … Shu, Y. (2024). AAV1-hOTOF gene therapy for autosomal recessive deafness 9: A single-arm trial. Lancet (London, England), 403(10441), 2317–2325. https://doi.org/10.1016/S0140-6736(23)02874-X
Martínez-Vega, R., Garrido, F., Partearroyo, T., Cediel, R., Zeisel, S. H., Martínez-Álvarez, C., Varela-Moreiras, G., Varela-Nieto, I., y Pajares, M. A. (2015). Folic acid deficiency induces premature hearing loss through mechanisms involving cochlear oxidative stress and impairment of homocysteine metabolism. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 29(2), 418–432. https://doi.org/10.1096/fj.14-259283
Martínez-Vega, R., Partearroyo, T., Vallecillo, N., Varela-Moreiras, G., Pajares, M. A., y Varela-Nieto, I. (2015). Long-term omega-3 fatty acid supplementation prevents expression changes in cochlear homocysteine metabolism and ameliorates progressive hearing loss in C57BL/6J mice. The Journal of Nutritional Biochemistry, 26(12), 1424–1433. https://doi.org/10.1016/j.jnutbio.2015.07.011
Martinon, F. (2010). Signaling by ROS drives inflammasome activation. European Journal of Immunology, 40(3), 616–619. https://doi.org/10.1002/eji.200940168
Menardo, J., Tang, Y., Ladrech, S., Lenoir, M., Casas, F., Michel, C., Bourien, J., Ruel, J., Rebillard, G., Maurice, T., Puel, J.-L., y Wang, J. (2012). Oxidative stress, inflammation, and autophagic stress as the key mechanisms of premature age-related hearing loss in SAMP8 mouse Cochlea. Antioxidants & Redox Signaling, 16(3), 263–274. https://doi.org/10.1089/ars.2011.4037
Mianné, J., Chessum, L., Kumar, S., Aguilar, C., Codner, G., Hutchison, M., Parker, A., Mallon, A.-M., Wells, S., Simon, M. M., Teboul, L., Brown, S. D. M., y Bowl, M. R. (2016). Correction of the auditory phenotype in C57BL/6N mice via CRISPR/Cas9-mediated homology directed repair. Genome Medicine, 8(1), 16. https://doi.org/10.1186/s13073-016-0273-4
Murillo-Cuesta, S., Celaya, A. M., Cervantes, B., Bermúdez-Muñoz, J. M., Rodríguez-de la Rosa, L., Contreras, J., Sánchez-Pérez, I., y Varela-Nieto, I. (2021). Therapeutic efficiency of the APAF-1 antagonist LPT99 in a rat model of cisplatin-induced hearing loss. Clinical and Translational Medicine, 11(4), e363. https://doi.org/10.1002/ctm2.363
Murillo-Cuesta, S., Contreras, J., Zurita, E., Cediel, R., Cantero, M., Varela-Nieto, I., y Montoliu, L. (2010). Melanin precursors prevent premature age-related and noise-induced hearing loss in albino mice. Pigment Cell & Melanoma Research, 23(1), 72–83. https://doi.org/10.1111/j.1755-148X.2009.00646.x
Murillo-Cuesta, S., Lara, E., Bermúdez-Muñoz, J. M., Torres-Campos, E., Rodríguez-de la Rosa, L., López-Larrubia, P., Erickson, S. R., & Varela-Nieto, I. (2023). Protection of lipopolysaccharide-induced otic injury by a single dose administration of a novel dexamethasone formulation. Translational Medicine Communications, 8(1), 23. https://doi.org/10.1186/s41231-023-00156-6
Noble, K., Brown, L., Elvis, P., y Lang, H. (2022). Cochlear Immune Response in Presbyacusis: A Focus on Dysregulation of Macrophage Activity. Journal of the Association for Research in Otolaryngology: JARO, 23(1), 1–16. https://doi.org/10.1007/s10162-021-00819-x
Paplou, V., Schubert, N. M. A., y Pyott, S. J. (2021). Age-Related Changes in the Cochlea and Vestibule: Shared Patterns and Processes. Frontiers in Neuroscience, 15, 680856. https://doi.org/10.3389/fnins.2021.680856
Parekh, S., y Kaur, T. (2023). Cochlear inflammaging: Cellular and molecular players of the innate and adaptive immune system in age-related hearing loss. Frontiers in Neurology, 14, 1308823. https://doi.org/10.3389/fneur.2023.1308823
Partearroyo, T., Murillo-Cuesta, S., Vallecillo, N., Bermúdez-Muñoz, J. M., Rodríguez-de la Rosa, L., Mandruzzato, G., Celaya, A. M., Zeisel, S. H., Pajares, M. A., Varela-Moreiras, G., y Varela-Nieto, I. (2019). Betaine-homocysteine S-methyltransferase deficiency causes increased susceptibility to noise-induced hearing loss associated with plasma hyperhomocysteinemia. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 33(5), 5942–5956. https://doi.org/10.1096/fj.201801533R
Perin, P., Marino, F., Varela-Nieto, I., y Szczepek, A. J. (2021). Editorial: Neuroimmunology of the Inner Ear. Frontiers in Neurology, 12. https://www.frontiersin.org/articles/10.3389/fneur.2021.635359
Pizzino, G., Irrera, N., Cucinotta, M., Pallio, G., Mannino, F., Arcoraci, V., Squadrito, F., Altavilla, D., y Bitto, A. (2017). Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity, 2017, 8416763. https://doi.org/10.1155/2017/8416763
Ratnanather, J. T. (2020). Structural neuroimaging of the altered brain stemming from pediatric and adolescent hearing loss-Scientific and clinical challenges. Wiley Interdisciplinary Reviews. Systems Biology and Medicine, 12(2), e1469. https://doi.org/10.1002/wsbm.1469
Ren, H., Chen, J., Wang, Y., Zhang, S., y Zhang, B. (2013). Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. International Journal of Clinical and Experimental Pathology, 6(2), 230–241.
Ren, Y., Hyakusoku, H., Sagers, J. E., Landegger, L. D., Welling, D. B., y Stankovic, K. M. (2020). MMP-14 (MT1-MMP) Is a Biomarker of Surgical Outcome and a Potential Mediator of Hearing Loss in Patients With Vestibular Schwannomas. Frontiers in Cellular Neuroscience, 14, 191. https://doi.org/10.3389/fncel.2020.00191
Riquelme, R., Cediel, R., Contreras, J., la Rosa Lourdes, R., Murillo-Cuesta, S., Hernandez-Sanchez, C., Zubeldia, J. M., Cerdan, S., y Varela-Nieto, I. (2010). A comparative study of age-related hearing loss in wild type and insulin-like growth factor I deficient mice. Frontiers in Neuroanatomy, 4, 27. https://doi.org/10.3389/fnana.2010.00027
Roche, M. V., Yan, D., Guo, Y., Hamad, N., Young, J. I., Blanton, S. H., Gong, F., y Liu, X. Z. (2025). Whole-Genome DNA Methylation Analysis in Age-Related Hearing Loss. Genes, 16(5), 526. https://doi.org/10.3390/genes16050526
Saeed, A., Younis, O., Al-Awamleh, N., Qubbaj, F., Al-Sharif, Z., Sulaiman, S., Al-Taher, M., y Khreesha, L. (2025). ATOH-1 Gene Therapy in Acquired Sensorineural Hearing Loss: A Meta-Analysis and Bioinformatic Analysis of Preclinical Studies. Human Gene Therapy, 36(13–14), 989–1003. https://doi.org/10.1089/hum.2025.013
Sakurai, R., Kim, Y., Nishinakagawa, M., Hinakura, K., Fujiwara, Y., y Ishii, K. (2025). Neural correlates of age-related hearing loss: An MRI and FDG-PET study. Geriatrics & Gerontology International, 25(2), 300–306. https://doi.org/10.1111/ggi.15052
Salata, T. M., Ribeiro, B. N. de F., Muniz, B. C., Antunes, L. de O., Rosas, H. B., y Marchiori, E. (2019). Hearing disorders - findings on computed tomography and magnetic resonance imaging: Pictorial essay. Radiologia Brasileira, 52(1), 54–59. https://doi.org/10.1590/0100-3984.2016.0213
Seicol, B. J., Lin, S., y Xie, R. (2022). Age-Related Hearing Loss Is Accompanied by Chronic Inflammation in the Cochlea and the Cochlear Nucleus. Frontiers in Aging Neuroscience, 14, 846804. https://doi.org/10.3389/fnagi.2022.846804
Shearer, A. E., Hildebrand, M. S., Odell, A. M., y Smith, R. J. (1993). Genetic Hearing Loss Overview. In M. P. Adam, J. Feldman, G. M. Mirzaa, R. A. Pagon, S. E. Wallace, & A. Amemiya (Eds.), GeneReviews®. University of Washington, Seattle. http://www.ncbi.nlm.nih.gov/books/NBK1434/
Shi, X., Qiu, S., Zhuang, W., Yuan, N., Wang, C., Zhang, S., Sun, T., Guo, W., Gao, F., Yang, S., y Qiao, Y. (2017). NLRP3-inflammasomes are triggered by age-related hearing loss in the inner ear of mice. American Journal of Translational Research, 9(12), 5611–5618.
Someya, S., y Prolla, T. A. (2010). Mitochondrial oxidative damage and apoptosis in age-related hearing loss. Mechanisms of Ageing and Development, 131(7–8), 480–486. https://doi.org/10.1016/j.mad.2010.04.006
Speck, I., Arndt, S., Thurow, J., Blazhenets, G., Aschendorff, A., Meyer, P. T., y Frings, L. (2020). 18F-FDG PET Imaging of the Inferior Colliculus in Asymmetric Hearing Loss. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine, 61(3), 418–422. https://doi.org/10.2967/jnumed.119.231407
Teraoka, M., Hato, N., Inufusa, H., y You, F. (2024). Role of Oxidative Stress in Sensorineural Hearing Loss. International Journal of Molecular Sciences, 25(8). https://doi.org/10.3390/ijms25084146
Todic, J., Guinand, N., Lenoir, V., Senn, P., y Becker, M. (2022). Diagnostic value and prognostic significance of MRI findings in sudden sensorineural hearing loss. Laryngoscope Investigative Otolaryngology, 7(5), 1575–1583. https://doi.org/10.1002/lio2.922
Uraguchi, K., Maeda, Y., Takahara, J., Omichi, R., Fujimoto, S., Kariya, S., Nishizaki, K., y Ando, M. (2021). Upregulation of a nuclear factor-kappa B-interacting immune gene network in mice cochleae with age-related hearing loss. PloS One, 16(10), e0258977. https://doi.org/10.1371/journal.pone.0258977
Verger, A., Roman, S., Chaudat, R.-M., Felician, O., Ceccaldi, M., Didic, M., y Guedj, E. (2017). Changes of metabolism and functional connectivity in late-onset deafness: Evidence from cerebral 18F-FDG-PET. Hearing Research, 353, 8–16. https://doi.org/10.1016/j.heares.2017.07.011
Wang, J., y Puel, J.-L. (2020). Presbycusis: An Update on Cochlear Mechanisms and Therapies. Journal of Clinical Medicine, 9(1), 218. https://doi.org/10.3390/jcm9010218
Wegner, I., van Waes, A. M. A., Bittermann, A. J., Buitinck, S. H., Dekker, C. F., Kurk, S. A., Rados, M., y Grolman, W. (2016). A Systematic Review of the Diagnostic Value of CT Imaging in Diagnosing Otosclerosis. Otology & Neurotology: Official Publication of the American Otological Society, American Neurotology Society [and] European Academy of Otology and Neurotology, 37(1), 9–15. https://doi.org/10.1097/MAO.0000000000000924
Wilson, D. M., Cookson, M. R., Van Den Bosch, L., Zetterberg, H., Holtzman, D. M., y Dewachter, I. (2023). Hallmarks of neurodegenerative diseases. Cell, 186(4), 693–714. https://doi.org/10.1016/j.cell.2022.12.032
Yan, T., Weng, F., Ming, Y., Zhu, S., Zhu, M., Wang, C., Guo, C., y Zhu, K. (2024). Luminescence Probes in Bio-Applications: From Principle to Practice. Biosensors, 14(7), 333. https://doi.org/10.3390/bios14070333
Yang, W., Zhao, X., Chai, R., y Fan, J. (2023). Progress on mechanisms of age-related hearing loss. Frontiers in Neuroscience, 17, 1253574. https://doi.org/10.3389/fnins.2023.1253574
Conflicto de intereses
Los autores declaran no tener ningún conflicto de interés.
Contribuciones de los autores
BC, SMC, PLL e IVN: redacción y edición del original. BC, SMC, PLL e IVN: revisión del original. IVN y SMC: obtención de la financiación, revisión y supervisión.
Financiación
Esta investigación ha sido posible gracias a un proyecto de MICIU/AEI (referencia PID2023-147347OB-I00). SM es investigador senior del Centro de Investigación Biomédica en Red en Enfermedades Raras (CIBERER).
Agradecimientos
Agradecemos a Miguel Ángel Sánchez Vázquez por las ilustraciones.
Oficina Editorial
Corrección: Rita López
Producción: Glaux Publicaciones Académicas