Artículos de Investigación
La sinaptopatía coclear
1 Facultat de Medicina. Universitat de Vic - Universitat Central de Catalunya (UVic-UCC) / 2 Copenhagen Hearing and Balance Center (CHBC). Ear, Nose and Throat and Audiology clinic. Rigshospitalet University Hospital / 3 Hearing Systems section. Department of Health Technology. Technical University of Denmark (DTU).
 OPEN ACCESS
OPEN ACCESS
PEER REVIEWED
ARTÍCULO DE REVISIÓN
Resumen
El descubrimiento hace más de diez años de la sinaptopatía coclear (SC), la pérdida permanente de las conexiones sinápticas entre las células ciliadas internas y las neuronas del nervio auditivo, implicó un cambio de paradigma en el conocimiento del daño producido en las estructuras celulares de la periferia del sistema auditivo debido a la sobreexposición sonora y el envejecimiento. Hasta la fecha se entendía que el elemento más vulnerable eran las células ciliadas, particularmente las células ciliadas externas. En el paradigma clásico, la estimación de los umbrales auditivos mediante la audiometría tonal liminar era —y todavía es— la base de la evaluación audiológica clínica. El descubrimiento de la SC urge al desarrollo de nuevos métodos diagnósticos más precisos para detectar daño auditivo oculto a la audiometría y al desarrollo de pruebas más específicas para distintos tipos de daños celulares periféricos. En el presente artículo se revisa la bibliografía científica asociada a la SC en modelos animales no humanos, se exponen las pruebas de la presencia de SC en humanos a partir de los estudios en cadáveres y se repasan los distintos estudios poco concluyentes en humanos vivos usando técnicas psicoacústicas y fisiológicas. Por último, se indican algunas de las investigaciones en marcha actualmente en algunas universidades europeas y las futuras perspectivas de diagnóstico y tratamiento de las pérdidas auditivas periféricas.
Palabras clave
Hipoacusia oculta, audiología, nervio auditivo, audiograma, sinapsis, potenciales evocados, artículo de revisión, modelos computacionales, fisiología
Repercusiones clínicas
La sinaptopatía coclear, la pérdida permanente de las conexiones sinápticas entre las células ciliadas internas y las neuronas del nervio auditivo, fue demostrada hace más de 10 años en modelos animales y, más recientemente, en cadáveres humanos. La pérdida sináptica no es detectable en la prueba de la audiometría tonal liminar, pero muy probablemente acarrea dificultades en la percepción de la señal acústica en ambientes con ruido. Es imprescindible que los profesionales en audiología clínica conozcan su existencia y que tomen seriamente a aquellos pacientes que, aun con umbrales audiométricos dentro del rango normal, puedan quejarse de problemas auditivos con frases del tipo "oigo lo que me dicen pero no lo entiendo".
Recibido: 23.10.2023 Revisado: 08.02.2024 Aceptado: 09.04.2024 Publicado: 02.08.2024
Editado por:
Helia Relaño-Iborra
Universidad de Rochester, EE.UU.
Eriksholm Research Center, Denmark.
Revisado por:
Carlos Gejo Linia
Universidad Católica San Antonio de Murcia, Murcia, España.
Enzo Aguilar-Vidal
Universidad de Chile, Santiago de Chile, Chile.
Joaquín Tomás Valderrama-Valenzuela
Universidad de Granada, Granada, España.
Macquarie University, Sydney, Australia.
Introducción
Desde hace más de siete décadas, la audiometría tonal liminar es indiscutiblemente la prueba fundamental para la evaluación audiológica. Si bien la utilidad práctica de la audiometría está fuera de toda duda, es sabido desde hace años que no es sensible a todas las posibles patologías de la periferia del sistema auditivo. Mientras que la elevación de los umbrales de audición medidos a través de la audiometría tonal está estrechamente asociada sobre todo con la pérdida o disfunción de las células ciliadas externas (CCE; Ryan and Dallos, 1975) y puede estar relacionada con la disfunción —que no la pérdida— de las células ciliadas internas (CCI; Liberman and Kiang, 1984), la audiometría es extremadamente insensible a la pérdida masiva pero distribuida de CCI (Lobarinas et al., 2013) y también a la pérdida de neuronas o fibras del nervio auditivo (NA; Schuknecht and Woellner, 1955). En la visión clásica de la hipoacusia por exposición a ruido se creía que las células ciliadas, en particular las CCE, eran los elementos más vulnerables del sistema auditivo periférico. En consecuencia, umbrales auditivos dentro del rango normal (umbral auditivo < 20 dB hearing level (HL) en frecuencias estándar de 125 Hz a 8 kHz) eran indicativos de un sistema auditivo sano, ya que las CCE (los elementos más vulnerables) debían estar sanas y ser funcionales para no manifestar una elevación de los umbrales. Sin embargo, en la clínica alrededor de un 5 % de pacientes se quejan de dificultades en la comprensión del habla, especialmente en situaciones ruidosas, incluso en los casos en que sus umbrales auditivos se encuentran dentro del rango normal (<20 dB HL; Hind et al., 2011; Tremblay et al., 2015; Kumar et al., 2007; Saunders and Haggard, 1989; Cantuaria et al., 2021). Esto sugiere la presencia de algún tipo de disfunción a lo largo de la vía auditiva, el cual se atribuía típicamente a estructuras neuronales centrales (es decir, el tronco cerebral) o corticales, no a la periferia. Esta afección se acuñó con el nombre de hipoacusia oculta (Schaette and McAlpine, 2011).
El presente trabajo pretende hacer un repaso de la bibliografía científica más relevante sobre la hipoacusia oculta o, más específicamente, sobre la sinaptopatía coclear (SC; vea la definición más adelante). Esta revisión, que se fundamenta en la experiencia investigadora del autor en este campo desde 2014, abarca desde el descubrimiento de la SC en 2009 en el modelo animal del ratón (Kujawa and Liberman, 2009) hasta la actualidad. El trabajo se centra en la definición de la SC basada en estudios de modelos animales y en el desarrollo de técnicas de diagnóstico, así como en los intentos de demostrar y medir la presencia de SC en humanos vivos. Los aspectos moleculares o cambios estructurales de la SC, además del desarrollo de técnicas de imagen, quedan fuera de esta revisión. Una versión más extensa de esta revisión se puede encontrar como capítulo en el Manual de audiología laboral de Peñuela et al. (2022). Una revisión de la bibliografía complementaria reciente se puede hallar en (Liu et al., 2024). En cuanto a la estructura de esta revisión, la primera parte se centra en los estudios de SC por exposición al ruido en modelos animales para seguir con los efectos del envejecimiento sobre la pérdida de sinapsis en el NA también en modelos animales. Seguidamente se hace un repaso de los distintos estudios sobre hipoacusia oculta en humanos y se expone la variabilidad y divergencia de los resultados no concluyentes. Por último, el presente trabajo concluye con una mirada hacia el futuro y las posibles perspectivas de nuevas técnicas diagnósticas y farmacológicas para el abordaje de la SC en humanos.
Sinaptopatía coclear debida a la exposición al ruido
La SC se describe como la desconexión, ruptura o pérdida permanente de las sinapsis que conectan con las CCI en la cóclea (Kujawa and Liberman, 2009). La SC se reportó por primera vez en ratones expuestos a un ruido de 105 dB de nivel de presión sonora (sound pressure level, SPL) durante dos horas que les produjo una elevación temporal inmediata de los umbrales de audición de unos 30-40 dB (medidos a través de pruebas de otoemisiones de productos de distorsión [DPOAE] y potenciales evocados del tronco cerebral [PEATC]), los cuales retornaron a valores preexposición pasadas unas dos semanas postexposición (fig. 1 H e I). Usando técnicas de imagen, los autores cuantificaron en distintas regiones cocleares la cantidad de CCI, fibras del NA y receptores sinápticos emparejados a cintas sinápticas en las CCI (fig. 1 A y B). Cada axón periférico del NA (filamentos verdes, fig. 1 A y B) hace una única conexión sináptica con una cinta sináptica (puntos rojos, fig. 1 A y B) en una CCI (núcleo de las CCI en azul, fig. 1 A y B). Se encontraron pérdidas de sinapsis de entre el 50-55 % en la zona basal de aquellos ratones expuestos al ruido en comparación con los ratones de control no expuestos. Mientras que los umbrales medidos a través de DPOAE y la onda I de los PEATC volvieron a valores preexposición (fig. 1 H e I), las pérdidas sinápticas fueron permanentes (no se halló recuperación de sinapsis con el tiempo). Además, no se halló evidencia de pérdida de CCI ni CCE en ninguna región coclear. A este respecto, no se hallaron diferencias entre los animales expuestos y los de control en mediciones de la amplitud de las DPOAE en función del nivel de estimulación (fig. 1H), ya que las CCE estaban intactas en los animales expuestos. Sin embargo, los animales expuestos al ruido sí presentaron efectos funcionales permanentes observados en una reducción permanente de la amplitud de la onda I de los PEATC a niveles supraliminares (fig. 1I). Otros estudios posteriores han evidenciado una clara correlación entre la amplitud del PEATC onda I y el porcentaje de supervivencia de las sinapsis cocleares (Sergeyenko et al., 2013; Parthasarathy and Kujawa, 2018). Se ha demostrado la presencia de SC en otros mamíferos como cobayas (Lin et al., 2011; Liu et al., 2012), ratas (Lobarinas et al., 2017), chinchillas (Hickman et al., 2018; Hickox et al., 2017), macacos Rhesus (Valero et al., 2017) y humanos (Makary et al., 2011; Viana et al., 2015; Wu et al., 2019).
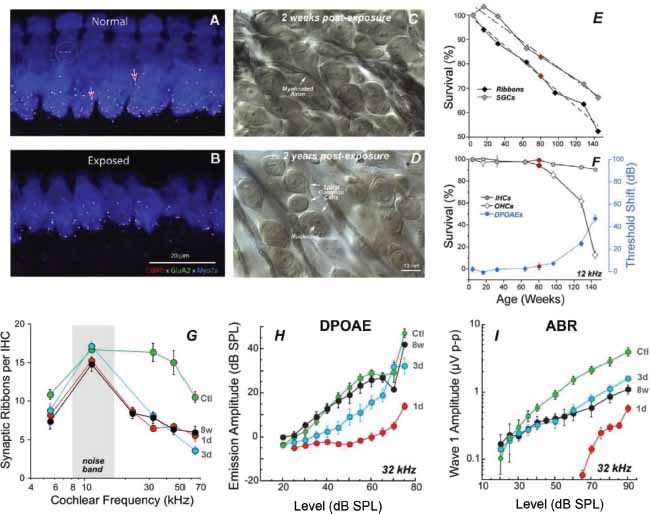
Fig. 1. Los paneles A y B muestran la pérdida de sinapsis en imágenes confocales inmunoteñidas de un ratón no expuesto y otro expuesto al ruido, respectivamente. Diferentes marcadores identifican las distintas estructuras: el CtBP2 (rojo) las cintas presinápticas, el GluA2 (verde) los receptores postsinápticos, y el Myosin VIIa (azul) las células ciliadas. Los paneles C y D muestran la degradación de las células del ganglio espiral en ratones expuestos al ruido en secciones cocleares teñidas con osmio pasadas dos semanas y dos años postexposición, respectivamente (Liberman and Kujawa, 2017). El panel E muestra la supervivencia de las cintas presinápticas y las células del ganglio espiral en función del envejecimiento. El panel F muestra la supervivencia de las CCI y las CCE en función del envejecimiento y su relación con las DPOAE (Sergeyenko et al., 2013). El panel G muestra la cuantificación de la pérdida de sinapsis en diferentes momentos postexposición (1d: 1 día, 3d: 3 días y 8w: 8 semanas) frente a ratones no expuestos (Ctl: control). Los paneles H e I muestran el efecto de la pérdida de sinapsis en las DPOAE y los PEATC, respectivamente, en función del nivel de estimulación. Tanto en las DPOAE como los PEATC, los umbrales no se ven afectados pasadas 8 semanas. Mientras que a niveles supraliminares las amplitudes de las DPOAE están totalmente recuperadas, los PEATC muestran una reducción de su amplitud a niveles altos (Kujawa and Liberman, 2009).
Figuras reproducidas con el permiso de los autores (Kujawa and Liberman, 2009; Liberman and Kujawa, 2017; Sergeyenko et al., 2013) y la editorial (Copyright 2009, Society for Neuroscience y licencia CC-BY-NC-SA)
Más allá de su descubrimiento inicial, los estudios posteriores indicaron que no todas las neuronas del NA se veían igualmente afectadas por la SC. El estudio de Furman et al. (2013) sugería que la pérdida de sinapsis era mucho más predominante en las fibras de tasa de espontaneidad baja y media, y que no afectaba demasiado a las neuronas de tasa de espontaneidad alta. En el NA se pueden distinguir entre dos y tres subgrupos de neuronas aferentes según su tasa de disparo espontáneo (es decir, el número de potenciales de acción generados en ausencia de estimulación). En gatos, que son sensibles a un intervalo frecuencial bajo y medio, se demostraron tres tipos de neuronas: las neuronas de tasa de espontaneidad alta (más de 18 disparos/segundo), las de tasa de espontaneidad media (entre 0,5 y 18 disparos/segundo) y las de tasa de espontaneidad baja (menos de 0,5 disparos/segundo; Liberman, 1978). En otros mamíferos sensibles a intervalos frecuenciales más altos, como los ratones, se han descrito dos tipos de neuronas: de espontaneidad alta (>1 disparos/segundo) y baja (<1 disparo/segundo; Taberner and Liberman, 2005). Se asume que los humanos tenemos un NA con características más parecidas al gato que al ratón, pero esto aún no se ha demostrado. La tasa de espontaneidad del disparo neuronal está asociada con el umbral de excitación neuronal. Las neuronas de espontaneidad alta son sensibles a umbrales bajos, mientras que las de espontaneidad baja lo son a umbrales altos (Liberman, 1978). Aparte de las distinciones funcionales, también hay diferencias morfológicas. Una misma CCI recibe conexiones sinápticas de los tres tipos de neuronas del NA (espontaneidad alta, media y baja), pero las neuronas de espontaneidad baja suelen inervar en el lado modiolar de la CCI, mientras que las de espontaneidad alta suelen hacerlo en el lado pilar. Además, las fibras de espontaneidad baja suelen tener axones más delgados y menos mitocondria, y las de espontaneidad alta tienen axones más gruesos y más mitocondria (Liberman, 1982). El estudio de Furman et al. (2013) usaba estos gradientes de inervación de las sinapsis del NA (es decir, el lado de las CCI en el que se inervaban las fibras) en animales expuestos en comparación con controles para concluir que había más pérdida de fibras de espontaneidad baja y media. Este dato estaba respaldado también por mediciones directas de fibras individuales que mostraron diferencias en las distribuciones estadísticas de la tasa de disparo espontáneo entre controles y animales expuestos.
El estudio de Furman et al. (2013) que indicaba que la SC era predominante en fibras de tasa de espontaneidad baja y media tuvo una alta influencia en el diseño de experimentos tanto electrofisiológicos como psicoacústicos en humanos. Además también aportaba una explicación del motivo por el cual los umbrales de audición no se veían afectados por la SC pero sí las respuestas supraliminares (es decir, la amplitud de la onda I de los PEATC a niveles altos), por el contrario. Si la SC no afectaba a las fibras de espontaneidad alta y umbrales bajos, estas podían seguir codificando las señales de baja intensidad usadas en las mediciones de umbrales; al mismo tiempo, la pérdida exclusiva de neuronas de espontaneidad baja y umbrales altos producía problemas de codificación de la señal acústica a niveles supraliminares. Sin embargo, algunos autores empezaron a cuestionar estos resultados y propusieron que la SC afectaba a todas las fibras del NA, indistintamente de su tasa de espontaneidad. En efecto, un recálculo de los datos de Furman et al. (2013) indicó que en el mismo estudio original había en realidad una pérdida de neuronas de espontaneidad alta de más del 26% que no se había notificado claramente (Marmel et al., 2015). Además, la mayoría de los estudios que usaron modelos computacionales para predecir el efecto de la SC se han visto forzados a aplicar en los modelos pérdidas significativas de fibras de espontaneidad alta (Paul et al., 2017; Verhulst et al., 2018; Encina-Llamas et al., 2019; Keshishzadeh et al., 2020, 2021; Johannesen et al., 2022). Un estudio más reciente hecho en ratones aporta pruebas de que la SC, al contrario de lo que sugerían Furman et al. (2013), no es predominante en fibras de espontaneidad baja y media (Suthakar and Liberman, 2021). Este estudio midió la respuesta directa de fibras individuales tanto en ratones de control como en ratones expuestos a un ruido que les generaba más del 50 % de SC. Las mediciones en las fibras del NA supervivientes en los ratones expuestos no mostraron ninguna diferencia en las distribuciones estadísticas de la tasa de disparo espontáneo ni en las propiedades neuronales en relación con las mediciones en los ratones de control, lo que sugiere que se perdían indistintamente los tres tipos de fibras debido a la exposición sonora. El hecho de que este último estudio fuera en ratones, igual que el estudio original de la SC de Kujawa and Liberman (2009), resulta interesante, ya que el estudio de Furman et al. (2013) se hizo en cobayas. Recientemente se ha demostrado que las cobayas son capaces de regenerar con el tiempo las sinapsis perdidas inmediatamente durante la exposición al ruido (Hickman et al., 2020, 2021; Shi et al., 2013), lo cual puede explicar la discrepancia entre los estudios en ratones y en cobayas y los modelos computacionales. En otras especies como las chinchillas no se ha observado evidencia de regeneración sináptica (Bharadwaj et al., 2022). En humanos, los estudios en huesos temporales extraídos de cadáveres muestran una clara pérdida de sinapsis con la edad, con una tasa de degeneración neuronal parecida a la del ratón (Wu et al., 2019, 2020), lo que sugiere la inexistencia de regeneración sináptica coclear en humanos.
Sinaptopatía coclear debida al envejecimiento
Debido al envejecimiento, el número de conexiones sinápticas activas entre el NA y las CCI va decreciendo de forma natural con la edad. En animales con un envejecimiento sano se demostró que la pérdida de sinapsis ocurre de forma estable y continua durante la vida del animal, llegando a valores del 50 % de pérdida en los ejemplares más viejos (Sergeyenko et al., 2013). Igual que en el caso de la SC por exposición sonora, la SC debida a la edad precede a la pérdida de células ciliadas y la elevación de umbrales (fig. 1F), las cuales son mínimas hasta edades avanzadas. La pérdida de sinapsis va seguida de la correspondiente pérdida de células del ganglio espiral pero con un desfase temporal (fig. 1E), muy parecida a la degeneración de toda la neurona del NA también hallada en huesos temporales humanos (Makary et al., 2011). La exposición al ruido provoca una aceleración de esta pérdida natural de sinapsis debida al envejecimiento (Fernandez et al., 2015). Los efectos funcionales de la SC debida a la edad son similares a los de la exposición sonora: las DPOAE no se ven alteradas siempre y cuando no haya pérdida de CCE, la amplitud de la onda I de los PEATC se reduce en función de la edad en clara correlación con el número de sinapsis (Sergeyenko et al., 2013), y la amplitud de potenciales evocados de estado estable como las respuestas de seguimiento a la envolvente (envelope-following responses, EFR) también se reducen con la edad en correlación con el número de sinapsis (Parthasarathy and Kujawa, 2018).
Sinaptopatía coclear en humanos
La presencia de SC en humanos, que había generado mucho debate anteriormente entre la comunidad científica (Bramhall et al., 2019), se demostró finalmente a partir de los estudios histopatológicos en huesos temporales de cadáveres humanos (Wu et al., 2019, 2021). Estos estudios han mostrado en humanos una clara pérdida de sinapsis en función de la edad parecida a la de los animales no humanos, que ocurre en mayor proporción que la previa pérdida de células ciliadas. Sin embargo, los intentos de hallar evidencia de la SC en humanos vivos han sido mucho más controvertidos (Valderrama et al., 2022). Esto se debe a que los estudios en humanos vivos presentan varias complejidades añadidas con respecto a los estudios en animales no humanos: 1) la diversidad genética en humanos es mucho mayor a la de algunos roedores, sobre todo los ratones, que son casi copias genéticas unos de otros. Esto conlleva una mayor variabilidad de los efectos producidos por una misma agresión al sistema auditivo (p. ej., una exposición sonora) y mayor variabilidad de los posibles biomarcadores; 2) en los estudios en animales no humanos, los investigadores han dedicado mucho tiempo y esfuerzo en encontrar una intensidad de ruido y tiempo de exposición que provoque una pérdida destacable de sinapsis sin producir pérdida de células ciliadas; es decir, en los estudios en laboratorio con animales es posible estudiar la SC totalmente aislada de otras patologías, en humanos este control del daño es prácticamente imposible y distintas patologías (es decir, SC, pérdida y/o disfunción de CCE y CCI, degeneración de la estría vascular, pérdida de neuronas del ganglio espiral, etc.) estarán presentes al mismo tiempo en un mismo individuo; 3) en los estudios en humanos vivos es imposible, por razones éticas, hacer un estudio histopatológico del número de sinapsis presentes en la cóclea. Dicho de otra manera, no es posible conocer la referencia real.
Para lidiar con estos problemas, los investigadores han usado básicamente cuatro estrategias:
A) Evaluar la exposición sonora a lo largo de toda la vida del paciente a través de cuestionarios y relacionarla con uno o varios biomarcadores fisiológicos sensibles a la SC en animales no humanos. La mayoría de estos estudios, los cuales usaron la amplitud de la onda I de los PEATC como biomarcador de la SC, no encontraron correlaciones claras y significativas entre la amplitud de la onda I y la estimación de la exposición sonora (Prendergast et al., 2017a; Stamper and Johnson, 2015; Fulbright et al., 2017; Spankovich et al., 2017; Grinn et al., 2017; Ridley et al., 2018; Maele et al., 2021). Otros estudios han usado dosímetros para evaluar la exposición sonora, con el inconveniente de que la estimación de la exposición sonora tiene una evidente limitación temporal. Estos estudios bien no hallaron ningún efecto, bien solamente pequeños efectos en la latencia de los PEATC (Skoe and Tufts, 2018; Maele et al., 2021). Otros estudios usaron la magnitud de las EFR como biomarcador sin hallar ninguna asociación (Prendergast et al., 2017a; Guest et al., 2017b,a; Grose et al., 2017). Algunos estudios, sin embargo, sí han encontrado alguna relación entre la exposición sonora y una respuesta fisiológica relacionada con la SC, pero mostraron típicamente efectos débiles. Por ejemplo, se han notificado efectos en la amplitud de la onda I (Valderrama et al., 2018; Bramhall et al., 2018a), en la relación entre el potencial de sumación (PS) y el potencial de acción (PA; este último equivale a la onda I de los PEATC; Liberman et al., 2016; Grose et al., 2017), y en la magnitud de las EFR (Bharadwaj et al., 2015; Bramhall et al., 2021).
B) La segunda estrategia ha consistido también en evaluar la exposición sonora de los pacientes a lo largo de toda su vida mediante cuestionarios y relacionarla con una o varias medidas perceptivas asociadas a la SC a través de una argumentación heurística, es decir, siguiendo una composición lógica de argumentos no demostrada, como que la SC empeora la inteligibilidad del habla en ruido (Lopez-Poveda and Barrios, 2013; Lopez-Poveda, 2014). La mayoría de estos estudios no han mostrado ninguna correlación clara y significativa entre la estimación de la exposición sonora y distintas pruebas conductuales presumiblemente afectadas por la pérdida de sinapsis cocleares (Prendergast et al., 2017b; Yeend et al., 2017; Prell et al., 2018; Fulbright et al., 2017; Grinn et al., 2017; Maele et al., 2021; Grose et al., 2017; Guest et al., 2018). Un estudio sí mostró valores peores de inteligibilidad de habla en ruido en jóvenes estudiantes de música asignados al grupo de mayor riesgo de exposición sonora a través de su propia evaluación subjetiva (Liberman et al., 2016).
C) La tercera estrategia ha pretendido hallar correlaciones entre diferentes mediciones (fisiológicas y conductuales) presumiblemente sensibles a la SC derivadas de estudios en animales no humanos. Nuevamente, una colección de estudios han mostrado ausencia de correlaciones significativas entre la amplitud de la onda I y la inteligibilidad del habla en ruido (Fulbright et al., 2017; Grinn et al., 2017;
Maele et al., 2021; Prendergast et al., 2017b; Guest et al., 2018; Bramhall et al., 2018a; Johannesen et al., 2019), ni tampoco entre la magnitud de las EFR (Maele et al., 2021; Prendergast et al., 2017b; Guest et al., 2018) o la relación entre las amplitudes de las ondas I y V de los PEATC y la inteligibilidad en ruido (Guest et al., 2018); por el contrario, algún estudio sí reportó alguna correlación significativa con la inteligibilidad del habla en ruido. Por ejemplo, se asoció la relación entre el PS y el PA (o amplitud de la onda I) con la inteligibilidad del habla en ruido (Liberman et al., 2016; Grant et al., 2020), pero se ha demostrado que la fiabilidad de esta métrica no resulta muy sólida (Prendergast et al., 2018). La inteligibilidad del habla también se ha relacionado con la magnitud de las EFR (Mepani et al., 2021). Otro estudio mostró un empeoramiento de la inteligibilidad del habla en sujetos que mostraron diferencias más largas entre las latencias de las ondas I a V de los PEATC (indicador del tiempo de procesamiento neuronal entre el NA y el colículo inferior) y que además mostraban relaciones de las amplitudes de las ondas I a V menores (indicativo de mayor ganancia central, vea abajo; Valderrama et al., 2018). Por último, se ha reportado una correlación entre la latencia de la onda V de los PEATC medidos en ruido de enmascaramiento y la detección de la diferencia de tiempo interaural de la envolvente del estímulo acústico (Mehraei et al., 2016).
D) Finalmente, la cuarta y última estrategia ha consistido en hallar una relación entre la presencia de SC estimada a partir de mediciones derivadas de estudios en animales no humanos y la presencia de acúfenos (tinnitus). Distintos estudios han mostrado que, a pesar de existir una reducción de las amplitudes de la onda I de los PEATC en normoyentes presumiblemente relacionada con la presencia de SC, la amplitud de la onda V no se ha visto alterada (Burkard and Sims, 2001; Johannesen et al., 2019; Grose et al., 2019; Rumschlag et al., 2022; Johannesen and Lopez-Poveda, 2021; Schaette and McAlpine, 2011; Temboury-Gutierrez et al., 2024b). Este fenómeno se ha relacionado con el concepto de ganancia central, que explicaría una sobreexcitación del sistema auditivo central (es decir, el tronco cerebral) a través de una reducción de la inhibición neuronal central (Heeringa and van Dijk, 2014) para compensar la reducción de actividad de la periferia debida a la pérdida de sinapsis (Chambers et al., 2016; Auerbach et al., 2014; Sheppard et al., 2018; Mohrle et al., 2019; Johannesen and Lopez-Poveda, 2021; Salvi et al., 2017; Caspary et al., 2008; Lai et al., 2017; Parthasarathy et al., 2019; Diehl and Schaette, 2015), la cual produciría también una exageración de la actividad cortical (Zan et al., 2020). Una de las hipótesis actuales vincularía esta sobreexcitación central a la presencia de acúfenos; es decir, a una percepción sonora en ausencia de estimulación acústica externa real (Mohrle et al., 2016; Eggermont, 2017; Knipper et al., 2013; Schaette, 2014; Schaette and McAlpine, 2011). Algunos biomarcadores de SC se han relacionado también a la presencia de acúfenos, como el reflejo estapedial (Wojtczak et al., 2017), pero un estudio posterior no encontró tal vínculo (Guest et al., 2019). La reducción en la magnitud de las EFR también se ha asociado a los acúfenos (Paul et al., 2017), pero una revisión de este mismo estudio acabó determinando que el efecto no era estadísticamente significativo (Roberts et al., 2018).
En resumen, los estudios de SC en humanos vivos presentan resultados contradictorios y, por lo tanto, no son concluyentes; este factor invita a proponer nuevos estudios más imaginativos que combinen distintas técnicas y distintas pruebas, y que hagan uso de la tecnología más moderna y de toda la capacidad computacional.
Perspectivas en tratamientos y técnicas diagnósticas
Hoy en día no existe ningún tratamiento para revertir totalmente la hipoacusia, si bien existen soluciones que pretenden compensar o aliviar sus efectos mediante la rehabilitación auditiva usando prótesis auditivas como audífonos o implantes cocleares. No obstante, se especula que en las próximas décadas podrían desarrollarse soluciones farmacológicas para revertir o prevenir algunas de las deficiencias auditivas. Para que esto sea una realidad se necesitan tres componentes que deben desarrollarse en paralelo: 1) el desarrollo de fármacos específicos y eficientes que puedan restaurar de forma segura y sin efectos indeseados aquellas células dañadas, evaluados mediante los ensayos clínicos correspondientes; 2) el desarrollo de las técnicas quirúrgicas que permitan suministrar de forma eficiente y controlada los fármacos en las secciones dañadas de la cóclea; y 3) el desarrollo de técnicas diagnósticas precisas que permitan evaluar en un paciente individual el grado de degeneración y daño de los distintos tipos de células de la periferia del sistema auditivo. En el caso de la SC, durante los últimos años varias investigaciones se han centrado en el uso de factores neurotróficos que permitan la regeneración neuronal (Cassinotti et al., 2022; Suzuki et al., 2016; Foster et al., 2022b; Leake et al., 2020; Hashimoto et al., 2019), llegando a distintas fases en ensayos clínicos (Foster et al., 2022a). Estas técnicas pretenden hacer recrecer las sinapsis en aquellas neuronas del NA que han sufrido una desconexión sináptica y su reinervación a la CCI correspondiente. Si bien en menor medida, también se han reportado algunas técnicas y estrategias transtimpánicas de suministración farmacológica local en la cóclea (Maxwell et al., 2021; Foster et al., 2022a). Además, algunos cirujanos del hospital de Rigshospitalet en Copenhague (Dinamarca), entre otros, están desarrollando técnicas quirúrgicas de suministro farmacológico intracoclear conjuntamente con otros investigadores de la industria danesa de audiología (fuentes privadas del autor).
En relación con los diagnósticos personalizados y precisos, y a pesar de que no existen actualmente técnicas para la evaluación clínica de la SC, algunos investigadores están produciendo notables progresos. Como se ha discutido anteriormente, la SC en humanos se presentará muy probablemente entremezclada con otras pérdidas o disfunciones de células cocleares. En consecuencia, es razonable asumir que la solución deberá incorporar distintas mediciones experimentales, probablemente asistidas con modelos computacionales y combinadas de forma eficiente mediante modelos de inteligencia artificial (IA). En esta dirección, distintos estudios han usado modelos computacionales para predecir el efecto de la SC u otras pérdidas auditivas en distintas respuestas fisiológicas (Paul et al., 2017; Keshishzadeh et al., 2020; Verhulst et al., 2018; Encina-Llamas et al., 2019, 2021; Märcher-Rørsted et al., 2022). Recientemente, algunos estudios de la Universidad de Ghent en Bélgica han desarrollado un marco que combina modelos fisiológicos computacionales con modelos de IA que permiten desarrollar nuevas estrategias de procesamiento auditivo para compensar algunas patologías auditivas, como la SC o la pérdida de CCE (Bramhall et al., 2018b; Buran et al., 2022; Drakopoulos et al., 2021, 2022; Drakopoulos and Verhulst, 2023; Drakopoulos et al., 2023). A modo de resumen breve, existen buenos modelos fisiológicos computacionales capaces de predecir la respuesta del NA a cualquier estímulo acústico (Bruce et al., 2018; Verhulst et al., 2018) y es posible entrenar modelos de IA (redes neuronales) para producir respuestas casi idénticas a las del modelo fisiológico. Estos investigadores construyen dos modelos de IA: uno sano para simular la respuesta sana del NA y otro con alguna patología que simula la respuesta dañada. Sabiendo estas dos respuestas, construyen un tercer modelo de IA unido a la entrada del modelo patológico con el objetivo de reducir la diferencia entre la respuesta patológica y la sana (vea la fig. 1 en Drakopoulos and Verhulst, 2023), es decir, que la respuesta del modelo patológico se parezca a la del modelo sano (es decir, para compensar la pérdida); esto se aproximaría al procesamiento ideal de un audífono. Los autores han reportado que las pérdidas de CCE son más fácilmente compensables que las pérdidas de sinapsis.
Al mismo tiempo, los equipos de investigación a los cuales está afiliado el autor de este artículo en la Universidad Técnica de Dinamarca (DTU), conjuntamente con el Copenhagen Hearing and Balance Center (CHBC) en el hospital de Rigshospitalet de Copenhague, han refinado el modelo marco de Dau (2003) para simular respuestas electrofisiológicas cocleares (o electrococleografía, ECocG), tanto sanas como con distintos perfiles de daños auditivos periféricos (Temboury-Gutierrez et al., 2024a); con ello pretendemos desarrollar un modelo de IA que, a partir de una o varias respuestas de ECocG en un paciente individual, pueda predecir qué combinación de SC, disfunción de CCI y pérdida/disfunción de CCE sea la que más probablemente padezca ese paciente. Para ello, desarrollar modelos computacionales que puedan predecir de forma precisa la respuesta del NA en humanos son fundamentales. En base a estas investigaciones, potenciales evocados como las respuestas de seguimiento de frecuencia (frequency-following responses, FFR) parecen ser un biomarcador potencialmente sensible a la SC y robusto a otras pérdidas, como la pérdida o disfunción de CCE, en concordancia con lo que indicaron los modelos computacionales (Märcher-Rørsted et al., 2022; Temboury-Gutierrez et al., 2024b). Otros estudios parecidos en el modelo animal de la chinchilla corroborarían estos resultados en humanos. Un potencial evocado alternativo serían las EFR (Encina-Llamas et al., 2019; Keshishzadeh et al., 2020, 2021; Vasilkov et al., 2021), las cuales se mostraron sensibles a la SC en ratones (Parthasarathy and Kujawa, 2018). En resumen, parece que la combinación de potenciales evocados de estado estable con distintos tipos de modelos computacionales avanzados puede acercarnos a diagnósticos de precisión en humanos. Una vez esto se haya demostrado y sea sólido, deberemos encontrar maneras de adaptar estos métodos a los requisitos de la práctica clínica.
Conclusión
El paradigma clásico del daño producido por la sobreexposición sonora y el envejecimiento indicaba que el elemento más vulnerable de la periferia del sistema auditivo eran las CCE. En 2009 se demostró en ratones la existencia de SC, la pérdida permanente de las conexiones sinápticas entre las CCI y las neuronas del NA, anterior a la pérdida de células ciliadas. Esta pérdida sináptica no altera los umbrales de audición y, por lo tanto, es invisible a la audiometría tonal liminar, pero sí produce una reducción en la respuesta supraliminar del NA y, presumiblemente, conlleva problemas perceptivos en ambientes de ruido. La SC, que ha sido demostrada en varios mamíferos, incluidos los humanos, ocurre de forma natural con la edad y se ve acentuada por la sobreexposición sonora. Los estudios en humanos que han usado mediciones psicoacústicas no han podido ofrecer resultados totalmente concluyentes. Más recientemente, algunos potenciales evocados de estado estable, como las EFR o las FFR han mostrado más potencial para poder ser considerados buenos biomarcadores sensibles a la SC. Se espera que, en los próximos años, este tipo de potenciales junto con modelos computacionales fisiológicos y modelos de IA puedan servir para diagnosticar la SC en individuos humanos de forma precisa y fiable.
Bibliografía
Auerbach, B. D., Rodrigues, P. V., & Salvi, R. J. (2014). Central gain control in tinnitus and hyperacusis. Frontiers in Neurology, 5, 1-21, https://doi.org/10.3389/fneur.2014.00206.
Bharadwaj, H. M., Hustedt-Mai, A. R., Ginsberg, H. M., Dougherty, K. M., Muthaiah, V. P. K., Hagedorn, A., Simpson, J. M., & Heinz, M. G. (2022). Cross-species experiments reveal widespread cochlear neural damage in normal hearing. Communications Biology, 5, 733, https://doi.org/10.1038/s42003-022-03691-4.
Bharadwaj, H. M., Masud, S., Mehraei, G., Verhulst, S., & Shinn-Cunningham, B. G. (2015). Individual differences reveal correlates of hidden hearing deficits. The Journal of Neuroscience, 35, 2161-2172, https://doi.org/10.1523/JNEUROSCI.3915-14.2015.
Bramhall, N., Beach, E. F., Epp, B., Le Prell, C. G., Lopez-Poveda, E. A., Plack, C. J., Schaette, R., Verhulst, S., & Canlon, B. (2019). The search for noise-induced cochlear synaptopathy in humans: Mission impossible? Hearing Research, 377, 88-103, https://doi.org/10.1016/j.heares.2019.02.016.
Bramhall, N. F., Konrad-Martin, D., & McMillan, G. P. (2018a). Tinnitus and auditory perception after a history of noise exposure: Relationship to auditory brainstem response measures. Ear Hearing, 39, 881-894, https://doi.org/10.1097/AUD.0000000000000544.
Bramhall, N. F., McMillan, G. P., & Kampel, S. D. (2021). Envelope following response measurements in young veterans are consistent with noise-induced cochlear synaptopathy. Hearing Research, 408, 108310, https://doi.org/10.1016/j.heares.2021.108310.
Bramhall, N. F., McMillan, G. P., Kujawa, S. G., & Konrad-Martin, D. (2018b). Use of non-invasive measures to predict cochlear synapse counts. Hearing Research, 370, 113-119, https://doi.org/10.1016/j.heares.2018.10.006.
Bruce, I. C., Erfani, Y., & Zilany, M. S. (2018). A phenomenological model of the synapse between the inner hair cell and auditory nerve: Implications of limited neurotransmitter release sites. Hearing Research, 360, 40-54, https://doi.org/10.1016/j.heares.2017.12.016.
Buran, B. N., McMillan, G. P., Keshishzadeh, S., Verhulst, S., & Bramhall, N. F. (2022). Predicting synapse counts in living humans by combining computational models with auditory physiology. The Journal of the Acoustical Society of America, 151, 561-576, https://doi.org/10.1121/10.0009238.
Burkard, R. F. & Sims, D. (2001). The human auditory brainstem response to high click rates. American Journal of Audiology, 10, 53-61, https://doi.org/10.1044/1059-0889(2001/008).
Cantuaria, M. L., Pedersen, E. R., Waldorff, F. B., Sørensen, M., & Schmidt, J. H. (2021). Hearing examinations in southern denmark (hesd) database: a valuable tool for hearing-related epidemiological research. International Journal of Audiology, 60, 300-311, https://doi.org/10.1080/14992027.2020.1831702.
Caspary, D. M., Ling, L., Turner, J. G., & Hughes, L. F. (2008). Inhibitory neurotransmission, plasticity and aging in the mammalian central auditory system. Journal of Experimental Biology, 211, 1781-1791, https://doi.org/10.1242/jeb.013581.
Cassinotti, L. R., Ji, L., Borges, B. C., Cass, N. D., Desai, A. S., Kohrman, D. C., Liberman, M. C., & Corfas, G. (2022). Cochlear neurotrophin-3 overexpression at mid-life prevents age-related inner hair cell synaptopathy and slows age-related hearing loss. Aging Cell, 21, https://doi.org/10.1111/acel.13708.
Chambers, A. R., Resnik, J., Yuan, Y., Whitton, J. P., Edge, A. S., Liberman, M. C., & Polley, D. B. (2016). Central gain restores auditory processing following near-complete cochlear denervation. Neuron, 89, 867-879, https://doi.org/10.1016/j.neuron.2015.12.041.
Dau, T. (2003). The importance of cochlear processing for the formation of auditory brainstem and frequency following responses. The Journal of the Acoustical Society of America, 113, 936-950, https://doi.org/10.1121/1.1534833.
Diehl, P. U. & Schaette, R. (2015). Abnormal auditory gain in hyperacusis: Investigation with a computational model. Frontiers in Neurology, 6, 15, https://doi.org/10.3389/fneur.2015.00157.
Drakopoulos, F., Baby, D., & Verhulst, S. (2021). A convolutional neural-network framework for modelling auditory sensory cells and synapses. Communications Biology, 4, 827, https://doi.org/10.1038/s42003-021-02341-5.
Drakopoulos, F., Broucke, A. V. D., & Verhulst, S. (2023). A dnn-based hearing-aid strategy for real-time processing: One size fits all. IEEE https://ieeexplore.ieee.org/document/10094887/.
Drakopoulos, F., Vasilkov, V., Vecchi, A. O., Wartenberg, T., & Verhulst, S. (2022). Model-based hearing-enhancement strategies for cochlear synaptopathy pathologies. Hearing Research, 424, 108569, https://doi.org/10.1016/j.heares.2022.108569.
Drakopoulos, F. & Verhulst, S. (2023). A neural-network framework for the design of individualised hearing-loss compensation. IEEE/ACM Transactions on Audio, Speech, and Language Processing, 31, 2395-2409, https://doi.org/10.1109/TASLP.2023.3282093.
Eggermont, J. J. (2017). Effects of long-term non-traumatic noise exposure on the adult central auditory system. hearing problems without hearing loss. Hearing Research, 352, 12-22, https://doi.org/10.1016/j.heares.2016.10.015.
Encina-Llamas, G., Dau, T., & Epp, B. (2021). On the use of envelope following responses to estimate peripheral level compression in the auditory system. Scientific Reports, 11, 6962, https://doi.org/10.1038/s41598-021-85850-x.
Encina-Llamas, G., Harte, J. M., Dau, T., Shinn-Cunningham, B., & Epp, B. (2019). Investigating the effect of cochlear synaptopathy on envelope following responses using a model of the auditory nerve. Journal of the Association for Research in Otolaryngology, 20, 363-382, https://doi.org/10.1007/s10162-019-00721-7.
Fernandez, K. A., Jeffers, P. W., Lall, K., Liberman, M. C., & Kujawa, S. G. (2015). Aging after noise exposure: Acceleration of cochlear synaptopathy in “recovered” ears. The Journal of Neuroscience, 35, 7509-7520, https://doi.org/10.1523/JNEUROSCI.5138-14.2015.
Foster, A. C., Jacques, B. E., & Piu, F. (2022a). Hearing loss: The final frontier of pharmacology. Pharmacology Research Perspectives, 10, e00970, https://doi.org/10.1002/prp2.970.
Foster, A. C., Szobota, S., Piu, F., Jacques, B. E., Moore, D. R., Sanchez, V. A., & Anderson, J. J. (2022b). A neurotrophic approach to treating hearing loss: Translation from animal models to clinical proof-of-concept. The Journal of the Acoustical Society of America, 151, 3937-3946, https://doi.org/10.1121/10.0011510.
Fulbright, A., Prell, C. L., Griffiths, S., & Lobarinas, E. (2017). Effects of recreational noise on threshold and suprathreshold measures of auditory function. Seminars in Hearing, 38, 298-318, https://doi.org/10.1055/s-0037-1606325.
Furman, A. C., Kujawa, S. G., & Liberman, M. C. (2013). Noise-induced cochlear neuropathy is selective for fibers with low spontaneous rates. Journal of Neurophysiology, 110, 577-586, https://doi.org/10.1152/jn.00164.2013.
Grant, K. J., Mepani, A. M., Wu, P., Hancock, K. E., de Gruttola, V., Liberman, M. C., & Maison, S. F. (2020). Electrophysiological markers of cochlear function correlate with hearing-in-noise performance among audiometrically normal subjects. Journal of Neurophysiology, 124, 418-431, https://doi.org/10.1152/jn.00016.2020.
Grinn, S. K., Wiseman, K. B., Baker, J. A., & Prell, C. G. L. (2017). Hidden hearing loss? no effect of common recreational noise exposure on cochlear nerve response amplitude in humans. Frontiers in Neuroscience, 11, https://doi.org/10.3389/fnins.2017.00465.
Grose, J. H., Buss, E., & Elmore, H. (2019). Age-related changes in the auditory brainstem response and suprathreshold processing of temporal and spectral modulation. Trends in Hearing, 23, 233121651983961, https://doi.org/10.1177/2331216519839615.
Grose, J. H., Buss, E., & Hall, J. W. (2017). Loud music exposure and cochlear synaptopathy in young adults: Isolated auditory brainstem response effects but no perceptual consequences. Trends in Hearing, 21, 233121651773741, https://doi.org/10.1177/2331216517737417.
Guest, H., Munro, K. J., & Plack, C. J. (2017a). Tinnitus with a normal audiogram: Role of high-frequency sensitivity and reanalysis of brainstem-response measures to avoid audiometric over-matching. Hearing Research, 356, 116-117, https://doi.org/10.1016/j.heares.2017.10.002.
Guest, H., Munro, K. J., Prendergast, G., Howe, S., & Plack, C. J. (2017b). Tinnitus with a normal audiogram: Relation to noise exposure but no evidence for cochlear synaptopathy. Hearing Research, 344, 265-274, https://doi.org/10.1016/j.heares.2016.12.002.
Guest, H., Munro, K. J., Prendergast, G., Millman, R. E., & Plack, C. J. (2018). Impaired speech perception in noise with a normal audiogram: No evidence for cochlear synaptopathy and no relation to lifetime noise exposure. Hearing Research, 364, 142—151, https://doi.org/10.1016/j.heares.2018.03.008.
Guest, H., Munro, K. J., Prendergast, G., & Plack, C. J. (2019). Reliability and interrelations of seven proxy measures of cochlear synaptopathy. Hearing Research, 375, 34-43, https://doi.org/10.1016/j.heares.2019.01.018.
Hashimoto, K., Hickman, T. T., Suzuki, J., Ji, L., Kohrman, D. C., Corfas, G., & Liberman, M. C. (2019). Protection from noise-induced cochlear synaptopathy by virally mediated overexpression of nt3. Scientific Reports, 9, 15362, https://doi.org/10.1038/s41598-019-51724-6.
Heeringa, A. & van Dijk, P. (2014). The dissimilar time course of temporary threshold shifts and reduction of inhibition in the inferior colliculus following intense sound exposure. Hearing Research, 312, 38-47, https://doi.org/10.1016/j.heares.2014.03.004.
Hickman, T. T., Hashimoto, K., Liberman, L. D., & Liberman, M. C. (2020). Synaptic migration and reorganization after noise exposure suggests regeneration in a mature mammalian cochlea. Scientific Reports, 10, 19945, https://doi.org/10.1038/s41598-020-76553-w.
Hickman, T. T., Hashimoto, K., Liberman, L. D., & Liberman, M. C. (2021). Cochlear synaptic degeneration and regeneration after noise: Effects of age and neuronal subgroup. Frontiers in Cellular Neuroscience, 15, https://doi.org/10.3389/fncel.2021.684706.
Hickman, T. T., Smalt, C., Bobrow, J., Quatieri, T., & Liberman, M. C. (2018). Blast-induced cochlear synaptopathy in chinchillas. Scientific Reports, 8, 10740, https://doi.org/10.1038/s41598-018-28924-7.
Hickox, A. E., Larsen, E., Heinz, M. G., Shinobu, L., & Whitton, J. P. (2017). Translational issues in cochlear synaptopathy. Hearing Research, 349, 164-171, https://doi.org/10.1016/j.heares.2016.12.010.
Hind, S. E., Haines-Bazrafshan, R., Benton, C. L., Brassington, W., Towle, B., & Moore, D. R. (2011). Prevalence of clinical referrals having hearing thresholds within normal limits. International Journal of Audiology, 50, 708-716, https://doi.org/10.3109/14992027.2011.582049.
Johannesen, P. T., Buzo, B. C., & Lopez-Poveda, E. A. (2019). Evidence for age-related cochlear synaptopathy in humans unconnected to speech-in-noise intelligibility deficits. Hearing Research, 374, 35-48, https://doi.org/10.1016/j.heares.2019.01.017.
Johannesen, P. T., Leclere, T., Wijetillake, A., Segovia-Martínez, M., & Lopez-Poveda, E. A. (2022). Modeling temporal information encoding by the population of fibers in the healthy and synaptopathic auditory nerve. Hearing Research, 426, 108621, https://doi.org/10.1016/j.heares.2022.108621.
Johannesen, P. T. & Lopez-Poveda, E. A. (2021). Age-related central gain compensation for reduced auditory nerve output for people with normal audiograms, with and without tinnitus. iScience, 24, 102658, https://doi.org/10.1016/j.isci.2021.102658.
Keshishzadeh, S., Garrett, M., Vasilkov, V., & Verhulst, S. (2020). The derived-band envelope following response and its sensitivity to sensorineural hearing deficits. Hearing Research, 392, 107979, https://doi.org/10.1016/j.heares.2020.107979.
Keshishzadeh, S., Garrett, M., & Verhulst, S. (2021). Towards personalized auditory models: Predicting individual sensorineural hearing-loss profiles from recorded human auditory physiology. Trends in Hearing, 25, 233121652098840, https://doi.org/10.1177/2331216520988406.
Knipper, M., Dijk, P. V., Nunes, I., Rüttiger, L., & Zimmermann, U. (2013). Advances in the neurobiology of hearing disorders: Recent developments regarding the basis of tinnitus and hyperacusis. Progress in Neurobiology, 111, 17-33, https://doi.org/10.1016/j.pneurobio.2013.08.002.
Kujawa, S. G. & Liberman, M. C. (2009). Adding insult to injury: Cochlear nerve degeneration after “temporary” noise-induced hearing loss. The Journal of Neuroscience, 29, 14077-14085, https://doi.org/10.1523/JNEUROSCI.2845-09.2009.
Kumar, G., Amen, F., & Roy, D. (2007). Normal hearing tests: is a further appointment really necessary? Journal of the Royal Society of Medicine, 100, 66-66, https://doi.org/10.1258/jrsm.100.2.66-a.
Lai, J., Sommer, A. L., & Bartlett, E. L. (2017). Age-related changes in envelope-following responses at equalized peripheral or central activation. Neurobiology of Aging, 58, 191-200, https://doi.org/10.1016/j.neurobiolaging.2017.06.013.
Leake, P. A., Akil, O., & Lang, H. (2020). Neurotrophin gene therapy to promote survival of spiral ganglion neurons after deafness. Hearing Research, 394, 107955, https://doi.org/10.1016/j.heares.2020.107955.
Le Prell, C. G., Siburt, H. W., Lobarinas, E., Griffiths, S. K., & Spankovich, C. (2018). No reliable association between recreational noise exposure and threshold sensitivity, distortion product otoacoustic emission amplitude, or word-in-noise performance in a college student population. Ear Hearing, 39, 1057-1074, https://doi.org/10.1097/AUD.0000000000000575.
Liberman, M. & Kiang, N. Y.-S. (1984). Single-neuron labeling and chronic cochlear pathology. iv. stereocilia damage and alterations in rate- and phase-level functions. Hearing Research, 16, 75-90, https://doi.org/10.1016/0378-5955(84)90026-1.
Liberman, M. C. (1978). Auditory-nerve response from cats raised in a low-noise chamber. The Journal of the Acoustical Society of America, 63, 442-455, https://doi.org/10.1121/1.381736.
Liberman, M. C. (1982). Single-neuron labeling in the cat auditory nerve. Science, 216, 1239-1241, https://doi.org/10.1126/science.7079757.
Liberman, M. C., Epstein, M. J., Cleveland, S. S., Wang, H., & Maison, S. F. (2016). Toward a differential diagnosis of hidden hearing loss in humans. PLOS ONE, 11, e0162726, https://doi.org/10.1371/journal.pone.0162726.
Liberman, M. C. & Kujawa, S. G. (2017). Cochlear synaptopathy in acquired sensorineural hearing loss: Manifestations and mechanisms. Hearing Research, 349, 138-147, https://doi.org/10.1016/j.heares.2017.01. 003.
Lin, H. W., Furman, A. C., Kujawa, S. G., & Liberman, M. C. (2011). Primary neural degeneration in the guinea pig cochlea after reversible noise-induced threshold shift. Journal of the Association for Research in Otolaryngology, 12, 605-616, https://doi.org/10.1007/s10162-011-0277-0.
Liu, J., Stohl, J., & Overath, T. (2024). Hidden hearing loss: Fifteen years at a glance. Hearing Research, 443, 108967, https://doi.org/10.1016/j.heares.2024.108967.
Liu, L., Wang, H., Shi, L., Almuklass, A., He, T., Aiken, S., Bance, M., Yin, S., & Wang, J. (2012). Silent damage of noise on cochlear afferent innervation in guinea pigs and the impact on temporal processing. PLoS ONE, 7, e49550, https://doi.org/10.1371/journal.pone.0049550.
Lobarinas, E., Salvi, R., & Ding, D. (2013). Insensitivity of the audiogram to carboplatin induced inner hair cell loss in chinchillas. Hearing Research, 302, 113-120, https://doi.org/10.1016/j.heares.2013.03.012.
Lobarinas, E., Spankovich, C., & Le Prell, C. G. (2017). Evidence of “hidden hearing loss” following noise exposures that produce robust tts and abr wave-i amplitude reductions. Hearing Research, 349, 155-163, https://doi.org/10.1016/j.heares.2016.12.009.
Lopez-Poveda, E. A. (2014). Why do I hear but not understand? Stochastic undersampling as a model of degraded neural encoding of speech. Frontiers in Neuroscience, 8, 348, https://doi.org/10.3389/fnins.2014.00348.
Lopez-Poveda, E. A. & Barrios, P. (2013). Perception of stochastically undersampled sound waveforms: a model of auditory deafferentation. Frontiers in Neuroscience, 7, 124, https://doi.org/10.3389/fnins.2013.00124.
Maele, T. V., Keshishzadeh, S., Poortere, N. D., Dhooge, I., Keppler, H., & Verhulst, S. (2021). The variability in potential biomarkers for cochlear synaptopathy after recreational noise exposure. Journal of Speech, Language, and Hearing Research, 64, 4964-4981, https://doi.org/10.1044/2021_JSLHR-21-00064.
Makary, C. A., Shin, J., Kujawa, S. G., Liberman, M. C., & Merchant, S. N. (2011). Age-related primary cochlear neuronal degeneration in human temporal bones. Journal of the Association for Research in Otolaryngology, 12, 711-717, https://doi.org/10.1007/s10162-011-0283-2.
Märcher-Rørsted, J., Encina-Llamas, G., Dau, T., Liberman, M. C., Wu, P., & Hjortkjær, J. (2022). Age- related reduction in frequency-following responses as a potential marker of cochlear neural degeneration. Hearing Research, 414, 108411, https://doi.org/10.1016/j.heares.2021.108411.
Marmel, F., Rodríguez-Mendoza, M. A., & Lopez-Poveda, E. A. (2015). Stochastic undersampling steepens auditory threshold/duration functions: implications for understanding auditory deafferentation and aging. Frontiers in aging neuroscience, 7, 63, https://doi.org/10.3389/fnagi.2015.00063.
Maxwell, K. S., Robinson, J. M., Hoffmann, I., Hou, H. J., Searchfield, G., Baguley, D. M., McMurry, G., Piu, F., & Anderson, J. J. (2021). Intratympanic administration of oto-313 reduces tinnitus in patients with moderate to severe, persistent tinnitus: A phase 1/2 study. Otology Neurotology, 42, e1625-e1633, https://doi.org/10.1097/MAO.0000000000003369.
Mehraei, G., Hickox, A. E., Bharadwaj, H. M., Goldberg, H., Verhulst, S., Liberman, M. C., & Shinn-Cunningham, B. G. (2016). Auditory brainstem response latency in noise as a marker of cochlear synaptopathy. The Journal of Neuroscience, 36, 3755-3764, https://doi.org/10.1523/JNEUROSCI.4460-15.2016.
Mepani, A. M., Verhulst, S., Hancock, K. E., Garrett, M., Vasilkov, V., Bennett, K., de Gruttola, V., Liberman, M. C., & Maison, S. F. (2021). Envelope following responses predict speech-in-noise performance in normal- hearing listeners. Journal of Neurophysiology, 125, 1213-1222, https://doi.org/10.1152/jn.00620.2020.
Möhrle, D., Hofmeier, B., Amend, M., Wolpert, S., Ni, K., Bing, D., Klose, U., Pichler, B., Knipper, M., & Rüttiger, L. (2019). Enhanced central neural gain compensates acoustic trauma-induced cochlear impairment, but unlikely correlates with tinnitus and hyperacusis. Neuroscience, 407, 146-169, https://doi.org/10.1016/j.neuroscience.2018.12.038.
Möhrle, D., Ni, K., Varakina, K., Bing, D., Lee, S. C., Zimmermann, U., Knipper, M., & Rüttiger, L. (2016). Loss of auditory sensitivity from inner hair cell synaptopathy can be centrally compensated in the young but not old brain. Neurobiology of Aging, 44, 173-184, https://doi.org/10.1016/j.neurobiolaging.2016.05.001.
Parthasarathy, A., Bartlett, E. L., & Kujawa, S. G. (2019). Age-related changes in neural coding of envelope cues: Peripheral declines and central compensation. Neuroscience, 407, 21-31, https://doi.org/10.1016/j.neuroscience.2018.12.007.
Parthasarathy, A. & Kujawa, S. G. (2018). Synaptopathy in the aging cochlea: Characterizing early- neural deficits in auditory temporal envelope processing. The Journal of Neuroscience, 38, 7108-7119, https://doi.org/10.1523/JNEUROSCI.3240-17.2018.
Paul, B. T., Bruce, I. C., & Roberts, L. E. (2017). Evidence that hidden hearing loss underlies amplitude modulation encoding deficits in individuals with and without tinnitus. Hearing Research, 344, 170-182, https://doi.org/10.1016/j.heares.2016.11.010.
Peñuela, J. M., Oyarzabal, S. M., Batalla, F. N., López, R. H. S., & Herrero, T. V. (2022). Manual de audiología laboral. Lettera publicaciones. https://letterapublicaciones.com/producto/manual-de-audiologia-laboral/.
Prendergast, G., Guest, H., Munro, K. J., Kluk, K., Léger, A., Hall, D. A., Heinz, M. G., & Plack, C. J. (2017a). Effects of noise exposure on young adults with normal audiograms I: Electrophysiology. Hearing Research, 344, 68-81, https://doi.org/10.1016/j.heares.2016.10.028.
Prendergast, G., Millman, R. E., Guest, H., Munro, K. J., Kluk, K., Dewey, R. S., Hall, D. A., Heinz, M. G., & Plack, C. J. (2017b). Effects of noise exposure on young adults with normal audiograms II: Behavioral measures. Hearing Research, 356, 74-86, https://doi.org/10.1016/j.heares.2017.10.007.
Prendergast, G., Tu, W., Guest, H., Millman, R. E., Kluk, K., Couth, S., Munro, K. J., & Plack, C. J. (2018). Supra-threshold auditory brainstem response amplitudes in humans: Test-retest reliability, electrode montage and noise exposure. Hearing Research, 364, 38-47, https://doi.org/10.1016/j.heares.2018.04.002.
Ridley, C. L., Kopun, J. G., Neely, S. T., Gorga, M. P., & Rasetshwane, D. M. (2018). Using thresholds in noise to identify hidden hearing loss in humans. Ear Hearing, 39, 829-844, https://doi.org/10.1097/AUD.0000000000000543.
Roberts, L. E., Paul, B. T., & Bruce, I. C. (2018). Erratum and comment: Envelope following responses in normal hearing and in tinnitus. Hearing Research, 361, 157-158, https://doi.org/10.1016/j.heares.2018.01.011.
Rumschlag, J. A., McClaskey, C. M., Dias, J. W., Kerouac, L. B., Noble, K. v., Panganiban, C., Lang, H., & Harris, K. C. (2022). Age-related central gain with degraded neural synchrony in the auditory brainstem of mice and humans. Neurobiology of Aging, 115, 50-59, https://doi.org/10.1016/j.neurobiolaging.2022.03.014.
Ryan, A. & Dallos, P. (1975). Effect of absence of cochlear outer hair cells on behavioural auditory threshold. Nature, 253, 44-6, https://doi.org/10.1038/253044a0.
Salvi, R., Sun, W., Ding, D., Chen, G.-D., Lobarinas, E., Wang, J., Radziwon, K., & Auerbach, B. D. (2017). Inner hair cell loss disrupts hearing and cochlear function leading to sensory deprivation and enhanced central auditory gain. Frontiers in Neuroscience, 10, 1-14, https://doi.org/10.3389/fnins.2016.00621.
Saunders, G. H. & Haggard, M. P. (1989). The clinical assessment of obscure auditory dysfunction— 1. Auditory and psychological factors. Ear and Hearing, 10, 200-208, https://doi.org/10.1097/00003446-198906000-00011.
Schaette, R. (2014). Tinnitus in men, mice (as well as other rodents), and machines. Hearing Research, 311, 63-71, https://doi.org/10.1016/j.heares.2013.12.004.
Schaette, R. & McAlpine, D. (2011). Tinnitus with a normal audiogram: Physiological evidence for hidden hearing loss and computational model. The Journal of Neuroscience, 31, 13452-13457, https://doi.org/10.1523/JNEUROSCI.2156-11.2011.
Schuknecht, H. F. & Woellner, R. C. (1955). An experimental and clinical study of deafness from lesions of the cochlear nerve. The Journal of Laryngology Otology, 69, 75-97, https://doi.org/10.1017/S0022215100050465.
Sergeyenko, Y., Lall, K., Liberman, M. C., & Kujawa, S. G. (2013). Age-related cochlear synaptopathy: An early-onset contributor to auditory functional decline. The Journal of Neuroscience, 33, 13686-13694, https://doi.org/10.1523/JNEUROSCI.1783-13.2013.
Sheppard, A., Liu, X., Ding, D., & Salvi, R. (2018). Auditory central gain compensates for changes in cochlear output after prolonged low-level noise exposure. Neuroscience Letters, 687, 183-188, https://doi.org/10.1016/j.neulet.2018.09.054.
Shi, L., Liu, L., He, T., Guo, X., Yu, Z., Yin, S., & Wang, J. (2013). Ribbon synapse plasticity in the cochleae of guinea pigs after noise-induced silent damage. PLoS ONE, 8, e81566, https://doi.org/10.1371/journal.pone.0081566.
Skoe, E. & Tufts, J. (2018). Evidence of noise-induced subclinical hearing loss using auditory brainstem responses and objective measures of noise exposure in humans. Hearing Research, 361, 80-91, https://doi.org/10.1016/j.heares.2018.01.005.
Spankovich, C., Prell, C. G. L., Lobarinas, E., & Hood, L. J. (2017). Noise history and auditory function in young adults with and without type 1 diabetes mellitus. Ear Hearing, 38, 724-735, https://doi.org/10.1097/AUD.0000000000000457.
Stamper, G. C. & Johnson, T. A. (2015). Auditory function in normal-hearing, noise-exposed human ears. Ear Hearing, 36, 172-184, https://doi.org/10.1097/AUD.0000000000000107.
Suthakar, K. & Liberman, M. C. (2021). Auditory-nerve responses in mice with noise-induced cochlear synaptopathy. Journal of Neurophysiology, 126, 2027-2038, https://doi.org/10.1152/jn.00342.2021.
Suzuki, J., Corfas, G., & Liberman, M. C. (2016). Round-window delivery of neurotrophin 3 regenerates cochlear synapses after acoustic overexposure. Scientific Reports, 6, 24907, https://doi.org/10.1038/srep24907.
Taberner, A. M. & Liberman, M. C. (2005). Response properties of single auditory nerve fibers in the mouse. Journal of Neurophysiology, 93, 557-569, https://doi.org/10.1152/jn.00574.2004.
Temboury-Gutierrez, M., Encina-Llamas, G., & Dau, T. (2024a). Predicting early auditory evoked potentials using a computational model of auditory-nerve processing. The Journal of the Acoustical Society of America, 155, 1799-1812, https://doi.org/10.1121/10.0025136.
Temboury-Gutierrez, M., Märcher-Rørsted, J., Bille, M., Yde, J., Encina-Llamas, G., Hjortkjær, J., & Dau, T. (2024b). Electrocochleographic frequency-following responses as a potential marker of age-related cochlear neural degeneration. Hearing Research, 446, 109005. https://doi.org/10.1016/j.heares.2024.109005
Tremblay, K. L., Pinto, A., Fischer, M. E., Klein, B. E. K., Klein, R., Levy, S., Tweed, T. S., & Cruickshanks, K. J. (2015). Self-reported hearing difficulties among adults with normal audiograms. Ear Hearing, 36, e290-e299, https://doi.org/10.1097/AUD.0000000000000195.
Valderrama, J. T., Beach, E. F., Yeend, I., Sharma, M., Dun, B. V., & Dillon, H. (2018). Effects of lifetime noise exposure on the middle-age human auditory brainstem response, tinnitus and speech-in-noise intelligibility. Hearing Research, 365, 36-48, https://doi.org/10.1016/j.heares.2018.06.003.
Valderrama, J. T., de la Torre, A., & McAlpine, D. (2022). The hunt for hidden hearing loss in humans: From preclinical studies to effective interventions. Frontiers in Neuroscience, 16, https://doi.org/10.3389/fnins.2022.1000304.
Valero, M. D., Burton, J. A., Hauser, S. N., Hackett, T. A., Ramachandran, R., & Liberman, M. C. (2017). Noise-induced cochlear synaptopathy in rhesus monkeys (macaca mulatta). Hearing research, 353, 213-223, https://doi.org/10.1016/j.heares.2017.07.003.
Vasilkov, V., Garrett, M., Mauermann, M., & Verhulst, S. (2021). Enhancing the sensitivity of the envelope-following response for cochlear synaptopathy screening in humans: The role of stimulus envelope. Hearing Research, 400, 108132, https://doi.org/10.1016/j.heares.2020.108132.
Verhulst, S., Altoe, A., & Vasilkov, V. (2018). Computational modeling of the human auditory periphery: Auditory-nerve responses, evoked potentials and hearing loss. Hearing Research, 360, 55-75, https://doi.org/10.1016/j.heares.2017.12.018.
Viana, L. M., O’Malley, J. T., Burgess, B. J., Jones, D. D., Oliveira, C. A. C. P., Santos, F., Merchant, S. N., Liberman, L. D., & Liberman, M. C. (2015). Cochlear neuropathy in human presbycusis: Confocal analysis of hidden hearing loss in post-mortem tissue. Hearing Research, 327, 78-88, https://doi.org/10.1016/j.heares.2015.04.014.
Wojtczak, M., Beim, J. A., & Oxenham, A. J. (2017). Weak middle-ear-muscle reflex in humans with noise-induced tinnitus and normal hearing may reflect cochlear synaptopathy. eneuro, 4,ENEURO.0363- 17.2017, https://doi.org/10.1523/ENEURO.0363-17.2017.
Wu, P., Liberman, L. D., Bennett, K., de Gruttola, V., O’Malley, J. T., & Liberman, M. (2019). Primary neural degeneration in the human cochlea: Evidence for hidden hearing loss in the aging ear. Neuroscience, 407, 8-20, https://doi.org/10.1016/j.neuroscience.2018.07.053.
Wu, P., O’Malley, J. T., de Gruttola, V., & Liberman, M. C. (2020). Age-related hearing loss is dominated by damage to inner ear sensory cells, not the cellular battery that powers them. The Journal of Neuroscience, 40, 6357-6366, https://doi.org/10.1523/JNEUROSCI.0937-20.2020.
Wu, P., O’Malley, J. T., de Gruttola, V., & Liberman, M. C. (2021). Primary neural degeneration in noise-exposed human cochleas: Correlations with outer hair cell loss and word-discrimination scores. The Journal of Neuroscience, 41, 4439-4447, https://doi.org/10.1523/JNEUROSCI.3238-20.2021.
Yeend, I., Beach, E. F., Sharma, M., & Dillon, H. (2017). The effects of noise exposure and musical training on suprathreshold auditory processing and speech perception in noise. Hearing Research, 353, 224-236, https://doi.org/10.1016/j.heares.2017.07.006.
Zan, P., Presacco, A., Anderson, S., & Simon, J. Z. (2020). Exaggerated cortical representation of speech in older listeners: mutual information analysis. Journal of Neurophysiology, 124, 1152-1164, https://doi.org/10.1152/jn.00002.2020.
Conflicto de interés
El autor declara no tener conflictos de interés.
Financiación
Este trabajo ha sido financiado gracias a una beca de la GN Foundation (ref. 237) dentro del proyecto AudPhen (Auditory Phenotypes in Denmark) en el hospital de Rigshospitalet de Copenhague (Dinamarca).
Cómo citar:
Encina-Llamas, G. (2024).
La sinaptopatía coclear. Auditio, 8, e103.
https://doi.org/10.51445/sja.auditio.vol8.2024.103
Correspondencia
Gerard Encina-Llamas
Email: gerard.encina@umedicina.cat
Oficina Editorial
Corrección: Tomás Pérez Pazos
Traducción: Emma Goldsmith
Producción: Glaux Publicaciones Académicas
